
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Атом водню. Спектри. Електронні оболонки
|
|
Основною властивістю квантових систем є те, що вони мають дискретну структуру енергетичного спектру. У спектрі найменший рівень зветься основним, а всі інші збудженими.
При переході квантової системи з одного стаціонарного стану в інший випромінюється (поглинається) квант енергії, яка дорівнює різниці енергій відповідних стаціонарних станів:
 , (7.4)
, (7.4)
(  та
та  - енергії стаціонарних станів атому перед та після випромінювання (поглинання)).
- енергії стаціонарних станів атому перед та після випромінювання (поглинання)).
Спектри випромінювання атомів хімічних елементів, що знаходяться у газоподібному стані (гази, пари металів), мають лінійчатий характер. Найбільш простий і досліджений спектр має атом водню. Довжини хвиль його спектральних ліній можуть бути обчислені за формулою Бальмера – Ритца (узагальненою формулою Бальмера):
 . (7.5)
. (7.5)
Константа 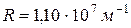 і має назву постійної Ридберга;
і має назву постійної Ридберга;  - довжина хвилі спектральної лінії;
- довжина хвилі спектральної лінії;  - номер енергетичного рівня атома, на який переходить електрон при випромінюванні;
- номер енергетичного рівня атома, на який переходить електрон при випромінюванні;  - номер рівня, з якого відбувається перехід.
- номер рівня, з якого відбувається перехід.
Серія ліній утворюється при переходах електронів на енергетичний рівень із фіксованим значенням  з усіх вищих рівнів
з усіх вищих рівнів  . Перша лінія кожної серії відповідає мінімальному значенню
. Перша лінія кожної серії відповідає мінімальному значенню  та має максимальну довжину хвилі. Границі кожної серії відповідає
та має максимальну довжину хвилі. Границі кожної серії відповідає  .
.
Повна енергія електрона в атомі водню або воднеподібному атомі (атомі із зарядовим числом Z, внаслідок іонізації якого, в електронній оболонці залишився тільки один електрон):
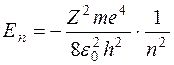 ,
,  (7.6)
(7.6)
З формули випливає, що електрон у атомі може мати тільки ті дискретні значення енергії, що визначаються квантовим числом  , яке називають головним квантовим числом.
, яке називають головним квантовим числом.
Випромінюваний квант енергії дорівнює
 ,
,  . (7.7)
. (7.7)
 та
та  - номера орбіт (тобто квантових рівнів енергії), між якими відбувається перехід електрона.
- номера орбіт (тобто квантових рівнів енергії), між якими відбувається перехід електрона.
 (с=3·108 м/с – швидкість світла у вакуумі). Тому для атома водню
(с=3·108 м/с – швидкість світла у вакуумі). Тому для атома водню 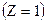 або воднеподібного атома
або воднеподібного атома  можна записати:
можна записати:
 . (7.8)
. (7.8)
З порівняння формули (7.8) при Z=1 із формулою (7.5) випливає, що останній вираз є аналогічним узагальненій формулі Бальмера, а стала Рідберга дорівнює 
 . (7.9)
. (7.9)
Енергія кванту енергії, що випромінюється атомом водню при переході електрону з однієї орбіти на другу,
 , (7.10)
, (7.10)
де Еі = 13,6 еВ – енергія іонізації атома водню.
Розглянемо фізичні властивості квантових систем. Квантовий стан характеризується дискретними значеннями таких основних фізичних величин, як енергія, момент імпульсу і т. ін.
Квантовий стан електрону в атомі залежить від відстані до ядра r і характеризується чотирма квантовими числами :
n – головне квантове число, визначає енергію Еn електрона в атомі, n=1,2,3,…;
l – орбітальне квантове число, визначає механічний орбітальний момент імпульсу електрона L:  . При заданому головному квантовому числі n приймає значення: l = 0, 1,…, n – 1; (7.10)
. При заданому головному квантовому числі n приймає значення: l = 0, 1,…, n – 1; (7.10)
ml – магнітне квантове число, визначає проекцію моменту імпульсу на фізично виділений напрямок:  . При заданому квантовому числі l приймає значення: m l = - l, - l + 1,…, 0, + 1,…, l – 1, l . (7.11)
. При заданому квантовому числі l приймає значення: m l = - l, - l + 1,…, 0, + 1,…, l – 1, l . (7.11)
ms – магнітне спінове квантове число, визначає проекцію спінового моменту імпульсу електрона на фізично виділений напрямок:  . Для електрона (а також протона і нейтрона) спінове квантове число s = ½, а
. Для електрона (а також протона і нейтрона) спінове квантове число s = ½, а
ms може приймати 2 значення: ms = 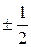 . (7.12)
. (7.12)
|
Просмотров 669 |
|
|
