
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Уравнение ВдВ. Закон соответственных состояний
|
|
Критическое состояние вещества. Закон соответственных состояний. Приведенные параметры смеси.
Для однокомпонентных систем обе фазы (жидкость и пар) при данном объеме могут присутствовать только в том случае, если давление в паровой области равно ДНП при заданной температуре Т.
 В некоторый момент времени свойства жидкости и пара становятся идентичны, исчезает понятие фаза, и эта точка называется критической.
В некоторый момент времени свойства жидкости и пара становятся идентичны, исчезает понятие фаза, и эта точка называется критической.
Пространственные диаграммы сложны, поэтому для простоты используются парные диаграммы состояния.

 - закритическая область
- закритическая область
 υк – тот максимальный объем, который может иметь вещество в жидком состоянии.
υк – тот максимальный объем, который может иметь вещество в жидком состоянии.
До открытия критической точки не понимали, почему из некоторых газов нельзя получить жидкость. Вывод: газ нужно охлаждать ниже Тк. Критическое состояние у всех индивидуальных веществ свои. Кристаллические (твердые) вещества принципиально отличаются от жидкостей и газов анизотропией.

Наличие критической точки говорит, что нет принципиальных различий между газом и жидкостью.
Уравнение ВдВ. Закон соответственных состояний.
Возьмем критическую точку в качестве базовой.
Ркр, Ткр, Vкр – базовые (масштабные) величины.







В критическом состоянии 
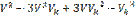 (2)
(2)
Уравнения (1) и (2) должны совпадать.
Приравниваем коэффициенты при равных степенях V.
 ;
; 

 ;
;  ;
; 
Обезразмерим уравнение ВдВ.
 ;
; 

 ;
; 
Перейдя к приведенным параметрам, мы получим уравнение состояния в безразмерном виде. Если в качестве единицы измерения возьмем критические значения P, V, T, то уравнение ВдВ становится одинаковым для всех индивидуальных веществ. Хотя в данном случае мы получили закон соответственных состояний на основе уравнения ВдВ, однако сам по себе закон соответственных состояний не связывают с конкретным видом уравнения состояния. Приведенные параметры смеси.В молекулярной физике описываются взаимодействия молекул иногда очень сложно построенных (особенно в случае многоатомных молекул). При таких сложных взаимодействиях для их описания и обозначения применяются методы термодинамического подобия. В основе метода лежат две идеи: 1)Описание явлений на основе масштабов, свойственных данному явлению или этой системе. Применение тех единиц измерения, которые задаются самой физической природой этой системы; 2)Следует из первой. Переход к использованию безразмерных, т.е. приведенных величин (если много систем, то сравнивать их можно только после обезразмеривания).


 ;
; 
По смыслу параметр zк – критерий термодинамического подобия. Две углеводородные системы, у которых zк одинаков, будут термодинамически подобны.
Если 2 из 3 приведенных параметров (Тп, Рп, Vп) для разных веществ совпадают, то 3 тоже совпадает, а состояния этих веществ будут соответственными. Но поскольку  , то для термодинамически подобных однокомпонентных систем состояние можно определить только по двум параметрам.
, то для термодинамически подобных однокомпонентных систем состояние можно определить только по двум параметрам.

zк – критерий термодинамического подобия
Для сложно построенных молекул силы взаимодействия этих молекул не действуют строго по линии, соединяющей центр молекул.

ω – ацентрический фактор
Для многокомпонентных систем закон соответственных состояний выполняется приближенно. Для смесей УВ газов приведенным параметром называется отношение действительного параметра к псевдопараметру.

В этих формулах любой критический параметр смеси находится чаще всего по правилу аддитивности Кэя. Здесь под аддитивностью понимается то, что суммарное свойство для смеси определяется как сумма произведений молярных долей каждого компонента смеси для данного свойства компонента.
 ;
; 
|
Просмотров 1336 |
|
|
