
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Математическая формулировка второго закона
|
|
Изобарный процесс
Основная статья: Изобарный процесс
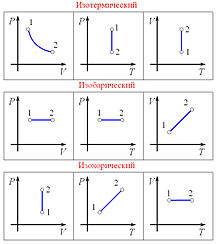
Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — процесс изменения состояния термодинамической системы при постоянном давлении (  )
)

Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком. Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном объёме (  ). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:

Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
Ещё стоит указать что поданная к газу энергия расходуется на изменение внутренней энергии то есть Q = 3* ν*R*T/2=3*V*ΔP, где R — универсальная газовая постоянная, ν количество молей в газе, T температура в Кельвинах, V объём газа, ΔP приращение изменения давления, а линию, изображающую изохорный процесс на диаграмме, в осях Р(Т), стоит продлить и пунктиром соединить с началом координат, так как может возникнуть недопонимание.
Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (  )(
)(  ). Изотермический процесс описывается законом Бойля — Мариотта:
). Изотермический процесс описывается законом Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
11.Основные расчётные соотношения для теплоёмкости идеального газа
Теплоёмкость идеального газа — отношение количества теплоты, сообщённого газу, к изменению температуры δТ, которое при этом произошло.

Теплоёмкость идеального газа в изопроцессах
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть  . Однако, объём, давление и температура меняются, то есть
. Однако, объём, давление и температура меняются, то есть  .
.
Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю:  .
.
В изотермическом процессе постоянна температура, то есть  . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна минус бесконечности:
. При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна минус бесконечности: 
Изохорный
В изохорном процессе постоянен объём, то есть 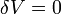 . Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (
. Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (  ). Первое Начало Термодинамики для изохорного процесса имеет вид:
). Первое Начало Термодинамики для изохорного процесса имеет вид:

А для идеального газа

Таким образом,

где  — число степеней свободы частиц газа.
— число степеней свободы частиц газа.
Другая формула:  , где γ — показатель адиабаты, R — универсальная газовая постоянная.
, где γ — показатель адиабаты, R — универсальная газовая постоянная.
Изобарный
Молярная теплоёмкость при постоянном давлении обозначается как  . В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера
. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера 
Вопрос№12 Энтропия .Тепловая диаграмма Т, s.Математическое выражение 2 закона термодинамики
Математическая формулировка второго закона
Термодинамики
Для обратимого цикла Карно можем записать:
 .
.
Отсюда следует:
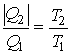 или
или  .
.
Величина Q2 – количество теплоты, отдаваемой рабочим телом, имеет знак минус, поэтому
 или
или 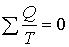 .
.
Отношение  называется приведённой теплотой, и полученное выражение можно прокомментировать так: в обратимом цикле Карно сумма приведенных теплот равна нулю.
называется приведённой теплотой, и полученное выражение можно прокомментировать так: в обратимом цикле Карно сумма приведенных теплот равна нулю.
Можно показать, что равенство нулю приведённой теплоты будет выполняться для любого обратимого цикла.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при замкнутых обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
Математически энтропия определяется как функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы:
 ,
,
где  — приращение энтропии;
— приращение энтропии;  — минимальная теплота, подведённая к системе;
— минимальная теплота, подведённая к системе;  — абсолютная температура процесса.
— абсолютная температура процесса.
Энтропия устанавливает связь между макро- и микро- состояниями. Особенность данной характеристики заключается в том, что это единственная функция в физике, которая показывает направленность процессов. Поскольку энтропия является функцией состояния, то она не зависит от того, как осуществлён переход из одного состояния системы в другое, а определяется только начальным и конечным состояниями системы.
 Система координат Т, s или, иначе, тепловая диаграмма Т, s имеет широкое применение при исследовании и расчете термодинамических процессов и циклов. В этой системе ось ординат является осью абсолютных температур, а ось абсцисс ? осью удельной энтропии. В системе координат Т, s так же, равновесное состояние газа изображаетсяuкак и в системе координат p, точкой, обратимый процесс ? некоторым графиком, а цикл ? замкнутой линией. Из основных соотношений обратимых процессов
Система координат Т, s или, иначе, тепловая диаграмма Т, s имеет широкое применение при исследовании и расчете термодинамических процессов и циклов. В этой системе ось ординат является осью абсолютных температур, а ось абсцисс ? осью удельной энтропии. В системе координат Т, s так же, равновесное состояние газа изображаетсяuкак и в системе координат p, точкой, обратимый процесс ? некоторым графиком, а цикл ? замкнутой линией. Из основных соотношений обратимых процессов  ; dq = Tds и
; dq = Tds и  следует, что в Т,s-диаграмме теплота, сообщаемая или отнимаемая от газа в обратимом процессе, изображается площадью, ограниченной линией процесса, ее крайними ординатами и осью абсцисс (рис. 3.8). Поэтому диаграмма T, s получила название тепловой диаграммы.
следует, что в Т,s-диаграмме теплота, сообщаемая или отнимаемая от газа в обратимом процессе, изображается площадью, ограниченной линией процесса, ее крайними ординатами и осью абсцисс (рис. 3.8). Поэтому диаграмма T, s получила название тепловой диаграммы.
13Водяной пар,основные понятия.Парообразование в p-sи T-s координатах
Известно, что любое вещество в зависимости от внешних условий (давления и температуры) может находиться в газообразном, жидком и твердом агрегатных состояниях, или фазах, а также одновременно находиться в двух или трех состояниях.
Переход вещества из одного агрегатного состояния в другое называется фазовым переходом, или фазовым превращением. Вещество в разных агрегатных состояниях имеет различные свойства, в частности плотность. Это различие объясняется характером межмолекулярного взаимодействия.
Переход вещества из твердого состояния в жидкое называется плавлением, из жидкого в газообразное — испарением, из твердого в газообразное — сублимацией. Обратные процессы соответственно называются затвердеванием, или кристаллизацией, конденсацией и де-сублимацией.
Процесс получения пара из жидкости может осуществляться испарением и кипением. Испарением называется парообразование, происходящее только со свободной поверхности жидкости и при любой температуре.
Кипением называется бурное парообразование по всей массе жидкости, которое происходит при сообщении жидкости через стенку сосуда определенного количества теплоты. При этом образовавшиеся у стенок сосуда и внутри жидкости пузырьки пара, увеличиваясь в объеме, поднимаются на поверхность жидкости.
Процесс парообразования начинается при достижении жидкостью температуры кипения, которая называется температурой насыщения tн и на протяжении всего процесса остается неизменной. Температура кипения, или температура насыщения, tн зависит от природы вещества и давления, причем с повышением давления tн увеличивается. Давление, соответствующее tн называется давлением насыщения рн.
Насыщенным паром называют пар, который образовался в процессе кипения и находится в динамическом равновесии с жидкостью. Насыщенный пар по своему состоянию бывает сухим насыщенным и влажным насыщенным.
Сухой насыщенный пар представляет собой пар, не содержащий капель жидкости и имеющий температуру насыщения (t=tн) при данном давлении.
Влажный насыщенный пар – это равновесная смесь, состоящая из капель жидкости, находящейся при температуре кипения, и сухого насыщенного пара.
Отношение массы сухого насыщенного пара mс.п. к массе влажного насыщенного пара mв.п. называется степенью сухости х влажного пара, то есть

|
Очевидно, что для жидкости х=0, для сухого насыщенного пара х=1.
Если к сухому насыщенному пару продолжать подводить теплоту, то его температура увеличится. Пар, температура которого при данном давлении больше, чем температура насыщения (t>tн), называется перегретым. Другими словами говоря перегретый пар – это пар, находящийся при температуре, превышающей температуру кипения жидкости при давлении, равном давлению перегретого пара. Величина превышения температурой пара температуры кипения жидкости называется степенью перегрева пара.
Водяной пар является реальным рабочим телом и может находиться в трёх состояниях: влажного насыщения, сухого насыщения и в перегретом состоянии. Для технических нужд водяной пар получают в паровых котлах (парогенераторах), где специально поддерживается постоянное давление.
Процесс парообразования в pv-координатах
За начальную температуру воды при любом давлении, принимают температуру t=0°С. Таким образом, линия I на рис. 6.2 соответствует состояниям так называемой холодной жидкости при разных давлениях, имеющей температуру 0°С (изотерма холодной жидкости). Удельный объем воды при t=0°С принимается равным 0,001 м3/кг. Вследствие незначительной сжимаемости воды, линия I оказывается почти вертикальной прямой.

|
За начало отсчета u, i и s для воды принято считать тройную точку TT (p0=611 Па, t0=0,01 0C, v0=0,00100 м3/кг).
Пренебрегая влиянием давления на изменение объема воды, считают для всех состояний на линии I v0=0,00100 м3/кг, u0=0, i0=0 и s0=0.
Конечное состояние воды в стадии подогрева (точка b) определяется достижением при заданном давлении температуры кипения, которая зависит от давления. Из рv—диаграммы следует, что с увеличением давления температура кипения увеличивается. Эта зависимость устанавливается опытным путем.
Состояния кипящей воды для различных давлений будут соответствовать линии II, которая называется нижней пограничной кривой. Она изображает зависимость удельных объемов кипящей воды от давления. На нижней пограничной кривой степень сухости х = 0.
Параметры кипящей воды приводятся в таблицах в зависимости их от давления или температуры. Количество теплоты, необходимое для доведения воды до кипения равно:

|
Дальнейший подвод теплоты к кипящей воде, который осуществляется в испарительном контуре парогенератора, сопровождается бурным парообразованием внутри жидкости и переходом части воды в пар. Таким образом, участку b—с будет соответствовать равновесное состояние смеси жидкости и пара (влажный насыщенный пар). В каждой точке этого процесса вода будет характеризоваться массовой долей содержащегося в ней сухого насыщенного пара (степенью сухости х).
Конечное состояние в этой стадии характеризуется полным превращением жидкости в пар, который будет иметь температуру, равную температуре насыщения (tc=tн) при заданном давлении. Такой пар, как уже упоминалось, носит название сухого насыщенного пара.
Процесс парообразования b—с является одновременно изобарным (p=p1=const) и изотермическим (T=T1=const). При этом затрачиваемая теплота расходуется не на повышение температуры, а только на преодоление сил притяжения между молекулами и на работу расширения пара.
Учитывая, что между температурой насыщения tн и давлением р существует однозначная связь, состояние сухого насыщенного пара будет определяться только одним параметром — давлением или температурой.
Состояния сухого насыщенного пара при разных давлениях будут соответствовать линии III, которая называется верхней пограничной кривой. Совершенно очевидно, что на верхней пограничной кривой в каждой точке степень сухости х=1.
Следует обратить внимание на то, что в процессе парообразования удельный объем воды резко увеличивается. Так, для воды при р = 0,1 МПа удельный объем кипящей воды v=0,001043 м3/кг, тогда как удельный объем сухого насыщенного пара равен 1,696 м3/кг. С увеличением давления эта разница уменьшается и в критической точке К удельные объёмы воды и пара равны 0,00326 м3/кг. При этом tкр=374,15 0С, а pкр=221,29 бар. При давлениях и температурах больших критических процесс парообразования отсутствует. Наблюдается переход воды в пар при пересечении изобары Tкр.
Вопрос№14 T- s и p-v,-диаграммы водяного пара
Is-диаграмма водяного пара
Для практических расчетов процессов водяного пара широкое применение получила is-диаграмма, на которой теплота и энтальпия измеряются линейными отрезками.
В системе координат i—s (рис. 6.3) сначала строятся нижняя (а-К) и верхняя (К—с) пограничные кривые по табличным данным i и s.
Нижняя пограничная кривая проходит через начало координат, так как при t=0 0С энтропия и энтальпия приняты равными нулю.
Затем наносят изобары, которые в области насыщенного пара, будучи одновременно и изотермами, являются прямыми линиями, так как при p=const dq=di, а  .
.  Поэтому di=T·ds и при T=const i=T·s+const. Следовательно, на is-диаграмме угловой коэффициент изобары равен T. Поэтому чем выше давление насыщения, тем выше температура T и тем больше тангенс угла наклона изобары.
Поэтому di=T·ds и при T=const i=T·s+const. Следовательно, на is-диаграмме угловой коэффициент изобары равен T. Поэтому чем выше давление насыщения, тем выше температура T и тем больше тангенс угла наклона изобары.
В области перегретого пара изобары и изотермы расходятся, причем изобары поднимаются кверху в виде логарифмических кривых, а изотермы стремятся к горизонтали. Это объясняется тем, что с понижением давления перегретый пар по свойствам приближается к идеальному газу, энтальпия которого зависит только то температуры, то есть линии t=const одновременно являются линиями i=const. Чем больше температура, тем выше расположена изотерма.
В области влажного пара нанесены линии одинаковой степени сухости х=const. На эту же диаграмму часто наносят еще изохоры, которые проходят круче изобар.
Is-диаграмма обладает рядом важных свойств: по ней можно быстро определить параметры пара и разность энтальпий в виде отрезков, наглядно изобразить адиабатный процесс, имеющий большое значение при изучении работы паровых двигателей, и решать другие задачи. Обычно для практического использования в большом масштабе строят так называемую рабочую часть диаграммы (на рис. 6.3 она ограничена штрих-пунктиром).
Вопрос15 Изображение цикла Ренкина в p-v и T диаграммах
Цикл Ренкина — термодинамический цикл
Рис. 3. И 
Нумерация точек совпадает с нумерацией на рис. 1. Процесс 1 – 2 – расширение пара в соплах турбины; 2 – 3 – процесс конденсации пара; 3 – 4 – процесс в питательном насосе;4 – 5 – процесс нагрева воды и ее кипение; 5 – 1 – процесс перегрева пара. Заштрихованы те области диаграмм, площадь которых численно равна работе и теплоте за цикл, причем qц = wц.
ллюстрация причины малого КПД цикла 
Синяя линия в Т-S диаграмме воды является разделительной, при энтропии и температуре соответствующим точкам лежащим на диаграмме выше этой линии существует только пар, ниже паро–водяная смесь.
Влажный пар в конденсаторе полностью конденсируется по изобаре p2=const (линия 2 - 3). Затем вода сжимается насосом от давления P2 до давления P1, этот адиабатный процесс изображен в T-S-диаграмме вертикальным отрезком 3-5.
Длина отрезка 3-5 в T-S-диаграмме весьма мала, так как в области жидкости, изобары (линии постоянного давления) в T-S-диаграмме проходят очень близко друг от друга. Благодаря этому при изоэптропном (при постоянной энтропии) сжатии воды, температура воды возрастает менее чем на 2 - 3 °С, и можно с хорошей степенью приближения считать, что в области жидкости изобары воды практически совпадают с левой пограничной кривой (синяя линия); поэтому зачастую при изображении цикла Ренкина в Т-S-диаграмме изобары в области жидкости изображают сливающимися с левой пограничной кривой. Малая величина отрезка адиабаты 3-5 свидетельствует о малой работе, затрачиваемой насосом на сжатие воды. Малая величина работы сжатия по сравнению с величиной работы, производимой водяным паром в процессе расширения 1-2, является важным преимуществом цикла Ренкина.
Из насоса вода под давлением P2 поступает в барабан сепаратор, а затем в реактор, где к ней в изобарно (процессе 5-4 P1=const) подводится тепло. Вначале вода в реакторе нагревается до кипения (участок 5-4 изобары P1=const) а затем, по достижении температуры кипения, происходит процесс парообразования (участок 4-1 изобары P1=const). Пароводяная смесь поступает в барабан сепаратор где происходит разделение воды и пара. Насыщенный пар, из барабана сепаратора поступает в турбину. Процесс расширения в турбине изображается адиабатой 1-2 (Этот процесс относится к классическому циклу Ренкина в реальной установке процесс расширения пара в турбине несколько отличается от классического). Отработанный влажный пар поступает в конденсатор, и цикл замыкается.
С точки зрения термического к. п. д. цикл Ренкина представляете менее выгодным, чем цикл Карно, изображенный выше (рисунок 5) поскольку степень заполнения цикла (равно как и средняя температур подвода тепла) для цикла Ренкина оказывается меньше, чем в случае цикла Карно. Однако с учетом реальных условий осуществления экономичность цикла Ренкина выше экономичности соответствующего цикла Карно во влажном паре.
16.Поршневой компрессор. Принцип действия. Процессы в компрессоре в p-v диаграмме.
Поршневой компрессор в основном состоит из рабочего цилиндра и поршня; имеет всасывающий и нагнетательный клапаны, расположенные обычно в крышке цилиндра. Для сообщения поршню возвратно-поступательного движения в большинстве поршневых компрессоров имеется кривошипно-шатунный механизм с коленчатым валом. Поршневые компрессоры – наиболее распространенные при производстве кондиционеров. Характерной особенностью таких компрессоров является размещение электродвигателя в герметичном корпусе компрессора. давление в герметичной камере создается при движении поршня вверх. Стандартный принцип действия компрессора поршневого типа обеспечивается за счет коленчатого вала и шатуна, как и в любом двигателе этого вида;После того, как в камере будет создано необходимое давление, срабатывают всасывающий и выпускной клапаны компрессора;Схема «а» показывает момент срабатывания всасывающего клапана, который открывается за счет разрежения, возникающего в камере в результате движения поршня вниз. При этом в камеру попадает хладагент, который находится в газообразном состоянии и имеет низкую температуру;Схема «б» показывает момент срабатывания выпускного клапана, который открывается под действием созданного поршнем давления при его движении вверх. После срабатывания этого клапана газообразный хладагент под высоким давлением устремляется в систему.Такой принцип действия компрессора отличается простотой и надежностью конструкции, но имеет несколько отрицательных качеств. Так, в результате резких скачков высокого и низкого давления работа компрессора кондиционера этого типа характеризуется высоким уровнем шума. Кроме того, для запуска такого компрессора необходим достаточный запас мощности, что в процессе работы ускоряет износ его деталей и приводит к поломке.На рис. 2.10 представлены две диаграммы в осях p – V теоретическая рабочая и p – v термодинамическая для процесса компремирования. Для идеального одноступенчатого компрессора этот процесс состоит из двух изобар и одной политропы с заданным показателем n.

Процесс 0 – 1 – всасывание исходной газовой среды, процесс 1 – 2 –сжатие, 2 – 3 – проталкивание сжатого газа потребителю.Площадь слева от кривой процесса сжатия pvn = const и представляет собой затраченную на сжатие газа работу (располагаемая работа):  Можно перейти к удельному объему v от геометрического V, если уделить последний на все количество газа m, вошедшего в цилиндр компрессора за весь процесс всасывания 0 – 1. Тогда техническая работа компрессора равна
Можно перейти к удельному объему v от геометрического V, если уделить последний на все количество газа m, вошедшего в цилиндр компрессора за весь процесс всасывания 0 – 1. Тогда техническая работа компрессора равна  (2.28) Снова воспользуемся уравнением политропы:pvn = const → pvn = p1v1n → v = v1p11/n p-1/n (2.29и подставим полученную зависимость v = v(p) в интеграл (2.28). Опять получается табличный интеграл, после преобразования результата интегрирования с помощью (2.29) окончательно приходим к равенству:w΄ = nw, где w рассчитывается по (2.24) или (2.25).Иными словами, работа, затраченная на компрессию газа (располагаемая) в n раз больше работы простого сжатия. Мощность двигателя для привода одноступенчатого идеального компрессора рассчитывается как: Nдвиг = Gw΄/η, Вт где G – массовый расход сжимаемого газа, кг/с, η – коэффициент полезного действия привода.
(2.28) Снова воспользуемся уравнением политропы:pvn = const → pvn = p1v1n → v = v1p11/n p-1/n (2.29и подставим полученную зависимость v = v(p) в интеграл (2.28). Опять получается табличный интеграл, после преобразования результата интегрирования с помощью (2.29) окончательно приходим к равенству:w΄ = nw, где w рассчитывается по (2.24) или (2.25).Иными словами, работа, затраченная на компрессию газа (располагаемая) в n раз больше работы простого сжатия. Мощность двигателя для привода одноступенчатого идеального компрессора рассчитывается как: Nдвиг = Gw΄/η, Вт где G – массовый расход сжимаемого газа, кг/с, η – коэффициент полезного действия привода.
17.Циклы двигателей внутреннего сгорания.
Принято, что идеальный цикл представляет собою совокупность последовательных процессов, совершаемых рабочим телом - идеальным газом - в цилиндре такой же идеальной машины. Эта условность позволяет устанавливать степень приближения цикла действительной машины, независимо от ее конструктивных особенностей, к идеальной.Двигатели внутреннего сгорания могут работать по одному из следующих трех циклов: с быстрым, постепенным и смешанным сгоранием.В первом случае тепло сообщается рабочему телу при постоянном объеме (V=const), во втором - при постоянном давлении (р = const), а смешанный цикл характеризуется подводом тепла к рабочему телу частично при постоянном объеме и переменном давлении, а затем частично при переменном объеме и постоянном давлении.К характерным особенностям двигателей, работающих со сгоранием при р = const и по смешанному циклу, относятся: высокая степень сжатия (ε = 12 ÷ 20), самовоспламенение топлива в результате высокого сжатия и применение тяжелых сортов топлива.Все карбюраторные, газовые и газогенераторные двигатели относятся к двигателям быстрого сгорания, так как воспламенение рабочей смеси у них происходит настолько быстро, что поршень не успевает сколько-нибудь существенно переместиться в цилиндре. РАБОЧИЕ ЦИКЛЫ ДВИГАТЕЛЕЙЧетырехтактный двигатель низкого сжатия. У четырехтактного двигателя рабочий процесс, как указывалось, происходит за четыре хода поршня, или, что то же, за два оборота коленчатого вала. Чтобы наглядно представить характер протекания процессов в рабочем цилиндре, пользуются индикаторной диаграммой, построенной в координатах давление - объем, характеризующих состояние газа в каждой точке объема цилиндра.I такт - всасывание. Поршень движется от в. м. т. к н. м. т. Объем над поршнем увеличивается, в результате чего в цилиндре образуется разрежение. Горючая смесь через открытый всасывающий клапан заполняет цилиндр. Давление газов при всасывании ниже атмосферного, что объясняется сопротивлением карбюратора и впускного трубопровода, и составляет 0,8-0,9 бар. Температура смеси в конце такта будет примерно на 20-30° С больше температуры окружающего воздуха.На индикаторной диаграмме процесс всасывания изображается линией).II такт - сжатие. Поршень движется от н. м. т. к в. м. т. при закрытых всех клапанах. Давление внутри цилиндра повышается до 6-12 бар, а температура смеси достигает 300-400° С.На индикаторной диаграмме процесс сжатия изображается линией bс.В карбюраторных двигателях воспламенение горючей смеси происходит при помощи электрической искры; в этом случае высокого сжатия не требуется, так как повышение степени сжатия горючей смеси может даже привести к ее преждевременному воспламенению или самовоспламенению, что вредно отражается на работе двигателя.III такт - рабочий ход. Горючая смесь в цилиндре, как указывалось, воспламеняется электрической искрой и, сгорая, выделяет большое количество тепла. Сгорание происходит при постоянном объеме.На индикаторной диаграмме процесс сгорания изобразится линией cz.В конце сгорания температура газов в цилиндре в зависимости от нагрузки возрастает до 1800° С, а давление - до 40 бар и выше. Под действием давления расширяющихся газов поршень движется к н. м. т. При этом давление газов в цилиндре падает до 4,5 бар, а температура снижается до 1150-1450° С.На индикаторной диаграмме рабочий ход изображается линией zd.IV такт - выпуск. После расширения газов поршень движется к в. м. т. Через открытый выпускной клапан из цилиндра удаляются отработавшие газы. В среднем давление газов при выпуске равно 1,2 бар, температура - около 500° С.На индикаторной диаграмме выпуск характеризуется линией da.Затем цикл повторяется в том же порядке.Таким образом, из четырех тактов цикла лишь один является рабочим, а остальные три - вспомогательными.
18.Смеси идеальных газов. Закон Дальтона.
Закон Дальтона — Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.  Для того чтоб понять, что представляет из себя закон Дальтона , рассмотрим для этого воздух в комнате. Он представляет собой смесь нескольких газов: азота (80%), кислорода (20%). Парциальное давление каждого из этих газов — это давление, которое имел бы газ, если бы он один занимал весь объем. К примеру, если бы все газы, кроме азота, удалили из комнаты, то давление того, что осталось, и было бы парциальным давлением азота. Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельнсти. (Строго говоря, закон применим только к идеальным газам, но с достаточно хорошим приближением он описывает также и реальные газы.)Так же, закон Дальтона описывает связь растворимости компонентов газовой смеси, которая пропорциональна их парциальному давлению.
Для того чтоб понять, что представляет из себя закон Дальтона , рассмотрим для этого воздух в комнате. Он представляет собой смесь нескольких газов: азота (80%), кислорода (20%). Парциальное давление каждого из этих газов — это давление, которое имел бы газ, если бы он один занимал весь объем. К примеру, если бы все газы, кроме азота, удалили из комнаты, то давление того, что осталось, и было бы парциальным давлением азота. Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельнсти. (Строго говоря, закон применим только к идеальным газам, но с достаточно хорошим приближением он описывает также и реальные газы.)Так же, закон Дальтона описывает связь растворимости компонентов газовой смеси, которая пропорциональна их парциальному давлению.  p- Давление смеси газов m- Масса растворимого газа P- Давление окружающей среды
p- Давление смеси газов m- Масса растворимого газа P- Давление окружающей среды
СМЕСИ ИДЕАЛЬНЫХ ГАЗОВВ двигателях внутреннего сгорания в процессе химической реакции топлива с кислородом воздуха образуются продукты сгорания, состоящие из смеси газов (углекислого газа, окиси углерода, водяного пара, водорода, кислорода, азота и др.). При решении ряда задач, связанных с изучением отдельных процессов в двигателе и его показателей, необходимо знать состав газовой смеси и количество каждого газа, являющегося компонентом этой смеси.Расчеты газовых смесей базируются на следующем. Каждый газ занимает весь объем, как если бы других газов и не было, и он находится в смеси под своим давлением р{, называемым парциальным. Давление смеси равно сумме парциальных давлений (закон Дальтона).Газовая смесь может быть задана в массовых и объемных единицах.2. Определение количества компонентов смеси газов в объемных единицахЕсли газ, находящийся в смеси под парциальным давлением рг, подвергнуть давлению смеси рсм при температуре Тсм, то он уже не будет занимать всего объема VCM, а лишь часть его Vv Этот объем Vi называютпарциальным объемом. Сумма парциальных объемов равна объему смеси.Сжатие каждого компонента газа до объема Vi рассматривалось при постоянной температуре, поэтому для любого i-ro компонента газа действительно уравнение откуда парциальное давление каждого газа.Если состав газа подсчитан не в объемных единицах, а в Mi кмолъ, то относительная доля каждого газа т4, входящего в состав смеси, будет также численно равна объемной доле г4 .3. Определение средней (кажущейся) молекулярной массы смесиПри проведении расчетов в случае газовой смеси удобно пользоваться величиной, характеризующей среднюю молекулярную массу смеси \iCM. В действительности, поскольку газовая смесь состоит из различных газов, такое понятие является условным и вводится в предположении, что рассматриваемый газ состоит из однородных молекул, масса которого равна массе смеси, а число кмолей равно Мсм.
19.Теплопроводность через цилиндрическую стенку.
Принцип расчета теплового потока через цилиндрическую стенку аналогична как и для плоской стенки. Рассмотрим однородную трубу (рис.12.2) с теплопроводностью l, внутренний диаметр d1, наружный диаметр d2, длина l. Внутри трубы находится горячая среда с температурой t'ж, а снаружи холодная среда с температурой t''ж.

Количество теплоты, переданной от горячей среды к внутренней стенке трубы по закону Ньютона-Рихмана имеет вид:Q = p·d1·a1·l·(t'ж – t1) , (12.9)где a1 – коэффициент теплоотдачи от горячей среды с температурой t'ж к поверхности стенки• с температурой t1;Тепловой поток, переданный через стенку трубы определяется по уравнению:Q = 2·p·l·l·(t1 – t2) / ln (d2/d1). (12.10)Тепловой поток от второй поверхности стенки трубы к холодной среде определяется по формуле:Q = p·d2·a2·l·(t1 - t''ж) , (12.11)где a2 – коэффициент теплоотдачи от второй поверхности стенки к холодной среде с температурой t''ж.Решая эти три уравнения получаем:Q = p l·(t'ж – t''ж) • К, (12.12)где Кl = 1/[1/(a1d1)+ 1/(2lln(d2/d1) + 1/(a2d2)] – (12.13)- линейный коэффициент теплопередачи, или Rl = 1/ Кl = [1/(a1d1)+ 1/(2lln(d2/d1) + 1/(a2d2)] – (12.14) полное линейное термическое сопротивление теплопередачи через однослойную цилиндрическую стенку. 1/(a1d1), 1/(a2d2) – термические сопротивления теплоотдачи поверхностей стенки;1/(2lln(d2/d1) - термическое сопротивление стенки.Для многослойной (n слоев) цилиндрической стенки полное линейное термическое сопротивление будет определяться по следующей формуле:Rl = 1/ Кl = [1/(a1d1)+ 1/(2l1ln(d2/d1) + 1/(2l3ln(d3/d2) + …+ 1/(2lnln(dn+1/dn) + 1/(a2dn)] – (12.15
20.Теплопередача. Уравнение теплопередачи.
Теплопередача — физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала. Когда физические тела одной системы находятся при разной температуре, то происходит передача тепловой энергии, или теплопередача от одного тела к другому до наступления термодинамического равновесия. Самопроизвольная передача тепла всегда происходит от более горячего тела к более холодному, что является следствием второго закона термодинамики.
Уравнение теплопередачи
Для функции u(x,y,z,t) трёх пространственных переменных (x,y,z) и времени t, уравнение теплопроводности имеет вид 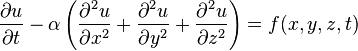
где  функция тепловых источников.
функция тепловых источников.
21.КОЛИЧЕСТВО ВОЗДУХА,НЕОБХОДИМОГО ДЛЯ ГОРЕНИЯ ТОПЛИВА.КОЭФФИЦИЕНТ ИЗБЫТКП ВОЗДУХА
Источником энергии, используемой в тепловых двигателях для получения механической работы, служит топливо — жидкое, газообразное, твердое. Химическими элементами топлива являются углерод, водород, кислород, азот, сера и др. Из этих элементов только углерод, водород и частично сера при горении выделяют тепло и составляют так называемую горючую часть топлива. К негорючей части относятся остальные элементы, являющиеся как бы балластом топлива. Горением называется процесс химического соединения (окисления) элементов горючей части топлива с кислородом воздуха, сопровождающийся выделением тепла и света.
Сгорание считается полным, если весь углерод, содержащийся в топливе, превращается в углекислый газ, а водород — в пары воды. Если в продуктах окисления имеются окись углерода или другие горючие вещества, то это свидетельствует о неполном сгорании. Для того чтобы очаг горения возник и поддерживался, необходимо воспламенить топливо и обеспечить непрерывный подвод к месту его образования окислителя (кислорода воздуха) и топлива. Воздух представляет собой смесь отдельных газов. По объему в нем содержится более 1/5 кислорода (20,95%) и около 4/5 (78,08%) азота. Небольшой процент (0,97%) составляют другие газы.
Азот — инертный газ, и при обычных условиях он не окисляется. Поэтому, когда говорят о подводе к очагу горения необходимого окислителя, подразумевают собственно подвод кислорода воздуха.
Сколько же нужно подвести воздуха, чтобы топливо сгорело полностью? Здесь на помощь приходит химия. Она позволяет определить теоретически потребное количество воздуха. Установлено, что для полного сгорания 1 кг жидкого дизельного топлива требуется около 14 кг воздуха..
Однако не весь кислород воздуха практически может принять участие в горении топлива. Следовательно, если к очагу горения подводить только теоретически необходимое количество воздуха, то сгорание будет неполным, а значит, и тепловой энергии при этом выделится меньше и часть топлива будет потеряна, выброшена на «ветер». Поэтому практически в цилиндры подводят значительно большее количество воздуха, чем требуется по теоретическим подсчетам. Это объясняется тем, что процесс перемешивания частиц жидкого топлива с воздухом происходит недостаточно совершенно. В то же время чрезмерно увеличивать количество подводимого воздуха невыгодно, так как для подвода воздуха необходимо затрачивать дополнительную энергию, которая не всегда окупается улучшением качества сгорания.
Отношение действительно подводимого количества воздуха к теоретически необходимому количеству принято называть коэффициентом избытка воздуха. Этот показатель обычно обозначают греческой буквой а. В реальных условиях невозможно добиться полного сгорания топлива при подаче теоретически необходимого количества воздуха. Поэтому в двигателях внутреннего сгорания подают несколько большее по сравнению с теоретической раскладкой количество воздуха. Действительное количество воздуха при сгорании топлива подсчитывают с учетом коэффициента избытка воздуха а
Lдв = Lтв ·a (1.11)
Коэффициентом избытка воздуха а называется отношение количества воздуха Lдв, действительно израсходованного на сгорание топлива, к количеству воздуха LTB, теоретически необходимого для полного сгорания топлива. Значение коэффициента избытка воздуха зависит от вида топлива, условий сжигания и конструкции двигателя и может составлять 0,85...1,5.
|
Просмотров 1166 |
|
|
