
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
|
|
| 1.Взаимодействие с металлами | 2CH3COOH+Ca à(CH3COO)2Ca+H2 ацетат кальция |
| 2.Взаимодействие с оксидами металлов | 2CH3COOH+CaO à(CH3COO)2Ca+H2O |
| 3.Реакция нейтрализации | 2CH3COOH+Ca(OH)2 à (CH3COO)2Ca + 2H2O |
| 4.Взаимодействие с солями | 2CH3COOH+CaCO3 à (CH3COO)2Ca + H2O + CO2 |
| 4*. Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия). В результате наблюдается выделение углекислого газа. 2CH3COOH+Na2CO3 à 2CH3COONa+H2O+CO2 | |
| 5.Реакция этерификации | 
|
| 6.Галогенирование кислот – реакция идёт в присутствии красного фосфора. | CH3COOH+Br2 –(Ркр)à CH2-COOH + НВr ô Br |
| 7.Образование галогенангидридов. | 
|
| 8. Образование амидов: | 
|
| Особенности муравьиной кислоты. | |
| 9. Разложение при нагревании. | НСООН –(H2SO4конц,t)à CO + H2O |
| 10. Реакция серебряного зеркала и с гидроксидом меди (II) – муравьиная кислота проявляет свойства альдегидов. | НCOOH + 2[Ag(NH3)2]OH à(NH4)2СО3+ 2Ag + 2NH3 + H2O HCOOH + Cu(OH)2 –tà CO2 + Cu2O + H2O |
| 11. Окисление хлором. | HCOOH + Cl2 à CO2 + 2HCl |
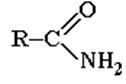
ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ – в них гидроксогруппа замещена на некоторые другие группы:
| Соли | Сложные эфиры | Галогенангидриды | Ангидриды | Амиды. |

| 
|

| СН3 – С=О \ О / СН3 – С=О |
|
Все они при гидролизе образуют карбоновые кислоты.
СЛОЖНЫЕ ЭФИРЫ
– это соединения, содержащие карбоксильную группу, связанную с двумя алкильными радикалами.
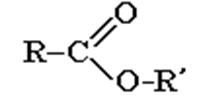
Общая формула сложных эфиров такая же, как у карбоновых кислот: CnH2nO2
ПОЛУЧЕНИЕ СЛОЖНЫХ ЭФИРОВ.
1)Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
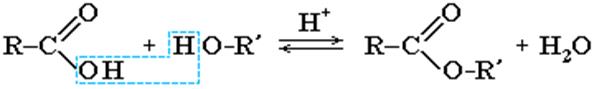
2) Сложные эфиры фенолов нельзя получить с помощью этерификации, для их получения используют реакцию фенолята с галогенангидридом кислоты:
С6Н5-О-Na+ + C2H5–C=O à NaCl + C6H5–O-C=O
\ \
Cl C2H5
Фениловый эфир пропановой кислоты
(фенилпропаноат)
НОМЕНКЛАТУРА СЛОЖНЫХ ЭФИРОВ.
Названия сложных эфиров определяются названиями кислоты и спирта, из которых они образуются.
| Формула эфира | Полное название | Другие названия. |
| СН3-С-ОСН3 ║ О | метиловый эфир уксусной кислоты | метилацетат уксусно-метиловый эфир |
| Н-С –ОС2Н5 ║ О | этиловый эфир муравьиной кислоты | этилформиат муравьино-этиловый эфир |
| С2Н5 -С–ОС3Н7 ║ О | пропиловый эфир пропановой (пропионовой) кислоты | пропилпропаноат (пропионат) |
Виды изомерии сложных эфиров.
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки—СО—О—. Этот вид изомерии начинаетсясо сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерияс карбоновыми кислотами.
СВОЙСТВА СЛОЖНЫХ ЭФИРОВ.
Гидролиз сложных эфиров.
Реакция этерификации обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
Кислотный гидролиз обратим:

Щелочной гидролиз протекает необратимо:

Эта реакция называется омылением сложного эфира.
2. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:

|
Просмотров 1687 |
|
|
