| ОРГАНИЧЕСКАЯ ХИМИЯ
|
| ДИЕНОВЫЕ УГЛЕВОДОРОДЫ
|
| |
|
|
а) Общая формула диеновых углеводородов СnН2n-2 где n > 3.
Например, первые три гомолога имеют формулы: С3Н4, С4Н6, С5Н8.
б) номенклатура и строение;
 Практическое значение имеют диеновые, в молекулах которых двойные связи разделены простой (одинарной) связью. Это: бутадиен — 1,3 (дивинил) СН2=СН-СН=СН2и 2-метилбутадиен —1,3 (изопрен)
Практическое значение имеют диеновые, в молекулах которых двойные связи разделены простой (одинарной) связью. Это: бутадиен — 1,3 (дивинил) СН2=СН-СН=СН2и 2-метилбутадиен —1,3 (изопрен)
 в) особенности химических свойств, подтвердив уравнениями реакций с водородом, бромом, бромоводородом.
Особенность диеновых углеводородов в том, что присоединение происходит по концам цепи, а между вторым и третьим атомами углерода образуется двойная связь:
в) особенности химических свойств, подтвердив уравнениями реакций с водородом, бромом, бромоводородом.
Особенность диеновых углеводородов в том, что присоединение происходит по концам цепи, а между вторым и третьим атомами углерода образуется двойная связь:

|
| |
| ОРГАНИЧЕСКАЯ ХИМИЯ
|
| ПОЛИМЕРЫ
|
| |
|
|
Строение макромолекул
Макромолекулы полимеров имеют различную геометрическую форму:
- а) линейную (полиэтилен, полипропилен);
- б) разветвленную (крахмал, гликоген);
- в) пространственную (вулканизированный каучук).
Полимеры могут иметь кристаллическое и аморфное строения. Под кристалличностью понимают упорядоченное расположение макромолекул. Аморфное строение характеризуется отсутствием упорядоченности.
Способы получения
Полимеры синтезируют полимеризацией и поликонденсацией. Реакция полимеризации — это процесс соединения молекул в более крупные молекулы.
 Это свободно-радикальный механизм.
Это свободно-радикальный механизм.
|
| |
| БЕНЗОЛ
|
| |
|
|
Электронное и пространственное строения
В бензоле все атомы углерода находятся во втором валентном состоянии (sр2-гибридизация).
 В результате на плоскости образуются три сигма-связи с атомами углерода и водорода. ( Шесть р-электронов, которые не участвовали в гибридизации, образуют общее 6р-электронное облако, которое стягивает бензольное кольцо, делая его более прочным, так как в результате перекрывания возникает единая делокализованная шестиэлектронная
В результате на плоскости образуются три сигма-связи с атомами углерода и водорода. ( Шесть р-электронов, которые не участвовали в гибридизации, образуют общее 6р-электронное облако, которое стягивает бензольное кольцо, делая его более прочным, так как в результате перекрывания возникает единая делокализованная шестиэлектронная  -система (4n + 2 = 6, где n = 1).
Электронная плотность —> связи равномерно распределена по всему циклу, что приводит к выравненности длин связей С—С (0,1397 нм). Однозамещенные бензола не имеют изомеров. -система (4n + 2 = 6, где n = 1).
Электронная плотность —> связи равномерно распределена по всему циклу, что приводит к выравненности длин связей С—С (0,1397 нм). Однозамещенные бензола не имеют изомеров.
 Основные химические свойства.
Реакции замещения:
Основные химические свойства.
Реакции замещения:
 Задача. В каком направлении пойдет реакция толуола с бромом:
Задача. В каком направлении пойдет реакция толуола с бромом:
- а) в присутствии катализатора;
- б) при освещении смеси веществ?
Напишите уравнения реакций.
Решение.
а) В присутствии катализатора замещение произойдет в бензольном кольце:
 б) При освещении замещение произойдет в метильной группе:
б) При освещении замещение произойдет в метильной группе:
 Это объясняется взаимным влиянием бензольного кольца и заместителя.
Задача. Приведите примеры реакций, показывающих сходство бензола:
Это объясняется взаимным влиянием бензольного кольца и заместителя.
Задача. Приведите примеры реакций, показывающих сходство бензола:
- а) с предельными углеводородами;
- б) с непредельными углеводородами.
В чем заключается различие в проявлении общих свойств?
Решение. Сходство бензола с предельными углеводородами — реакции замещения:
 Сходство с непредельными углеводородами — реакции присоединения (хлора или водорода):
Сходство с непредельными углеводородами — реакции присоединения (хлора или водорода):
 гексахлор-циклогексан
Реакции замещения идут у бензола легче, чем у предельных углеводородов, а реакции присоединения — труднее, чем у непредельных.
Задача. Напишите уравнения химических синтезов, используя схему:
гексахлор-циклогексан
Реакции замещения идут у бензола легче, чем у предельных углеводородов, а реакции присоединения — труднее, чем у непредельных.
Задача. Напишите уравнения химических синтезов, используя схему:
 Укажите условия реакций.
Решение.
Укажите условия реакций.
Решение.

 Задача. У каких из приведенных ниже соединений возможна цистрансизомерия?
1. а) бутена-1, б) пентена-2, 3) 2-метилбутена-2, г) 2-метил-пропена, д) олеиновой кислоты, е) изопренового каучука.
2. Приведите структурные формулы цис-, трансизомеров.
3. Чем объясняется наличие цис-, трансизомерии у веществ?
Решение.
1) а), в), г) не имеют, б), д), е) имеют цис-, трансизомеры:
Задача. У каких из приведенных ниже соединений возможна цистрансизомерия?
1. а) бутена-1, б) пентена-2, 3) 2-метилбутена-2, г) 2-метил-пропена, д) олеиновой кислоты, е) изопренового каучука.
2. Приведите структурные формулы цис-, трансизомеров.
3. Чем объясняется наличие цис-, трансизомерии у веществ?
Решение.
1) а), в), г) не имеют, б), д), е) имеют цис-, трансизомеры:

 цис-форма изопренового каучука
цис-форма изопренового каучука
 транс-форма изопренового каучука
3) Наличие цис-, трансизомерии объясняется отсутствием свободного вращения молекулы относительно двойной связи. Оно затруднено, потому что молекула в этом месте имеет плоскостное строение (sр2-гибридизация двух атомов углерода, образующих двойную связь).
Необходимым условием для наличия цис-, трансизомеров является также наличие разных заместителей у атомов углерода, образующих двойную связь.
транс-форма изопренового каучука
3) Наличие цис-, трансизомерии объясняется отсутствием свободного вращения молекулы относительно двойной связи. Оно затруднено, потому что молекула в этом месте имеет плоскостное строение (sр2-гибридизация двух атомов углерода, образующих двойную связь).
Необходимым условием для наличия цис-, трансизомеров является также наличие разных заместителей у атомов углерода, образующих двойную связь.
|
| СВОЙСТВА АЦЕТИЛЕНА
|
| |
|
|
Свойства ацетилена, на основании которых он применяется в органических синтезах.
Получение ацетальдегида по методу Кучерова:
 Получение хлорвинила, полимеризация его в полихлорвинил (плащи, клеенки, трубы, изоляция провода):
Получение хлорвинила, полимеризация его в полихлорвинил (плащи, клеенки, трубы, изоляция провода):
 Получение винилацетилена реакцией димеризации и на его основе - хлоропренового каучука:
Получение винилацетилена реакцией димеризации и на его основе - хлоропренового каучука:
 С Получение бензола тримеризацией ацетилена по методу Н.Д. Зелинского:
С Получение бензола тримеризацией ацетилена по методу Н.Д. Зелинского:
 Получение акрилонитрила и его полимеризация в полиакрилонитрил (синтетическое волокно нитрон):
Получение акрилонитрила и его полимеризация в полиакрилонитрил (синтетическое волокно нитрон):
 Для бутена-2 хара
Для бутена-2 хара  ктерны цис-, трансизомеры: ктерны цис-, трансизомеры:
 При всех реакциях образуются высокомолекулярные вещества — полимеры из низкомолекулярных — мономеров. Реакции идут по месту разрыва
При всех реакциях образуются высокомолекулярные вещества — полимеры из низкомолекулярных — мономеров. Реакции идут по месту разрыва  -связей.
Реакция полимеризации: соединяются сразу много мономеров, побочных продуктов не образуется.
Реакция поликонденсации: соединяются постепенно разные мономеры с образованием побочных продуктов реакции.
Реакция сополимеризации: происходит одновременно и присоединение, и полимеризация разных мономеров.
2) -связей.
Реакция полимеризации: соединяются сразу много мономеров, побочных продуктов не образуется.
Реакция поликонденсации: соединяются постепенно разные мономеры с образованием побочных продуктов реакции.
Реакция сополимеризации: происходит одновременно и присоединение, и полимеризация разных мономеров.
2)
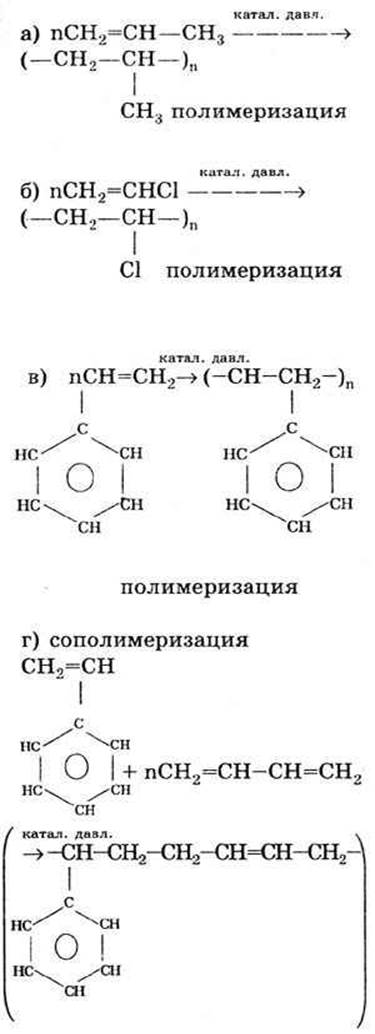 д) полимеризация
д) полимеризация

|
| ОРГАНИЧЕСКАЯ ХИМИЯ
|
| СПОСОБЫ ПОЛУЧЕНИЯ БЕНЗОЛА, ТОЛУОЛА, ЭТИЛБЕНЗОЛА, СТИРОЛА
|
| |

|
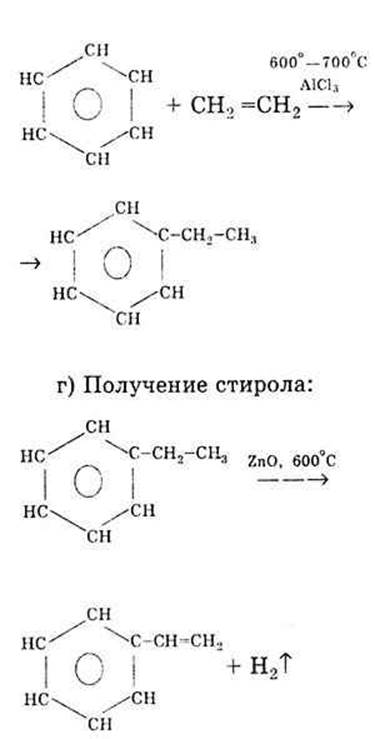
а) Получение бензола:
в) Получение этилбензола:
|
| ФОРМУЛА ПРЕДЕЛЬНОГО УГЛЕВОДОРОДА
|
| |
|
|
Формула предельного углеводорода, содержащего:
- а) только первичные атомы углерода в цепи;
- 6) первичные и вторичные углеродные атомы;
- в) первичные и третичные;
- г) первичные и четвертичные;
- д) первичные, вторичные и третичные;
- е) первичные, вторичные, третичные и четвертичные атомы углерода.
 Задача. Изобразите структурные формулы изомеров, имеющих молекулярную формулу С5Н8 и назовите их по международной номенклатуре.
Решение: С5Н8
Задача. Изобразите структурные формулы изомеров, имеющих молекулярную формулу С5Н8 и назовите их по международной номенклатуре.
Решение: С5Н8
 Задача. Сколько изомеров могут соответствовать эмпирической формуле СГ)НК1? Напишите структурные формулы этих изомеров и назовите их.
Решение. С5Н8
Задача. Сколько изомеров могут соответствовать эмпирической формуле СГ)НК1? Напишите структурные формулы этих изомеров и назовите их.
Решение. С5Н8

|
| ВИДЫ ИЗОМЕРИИ
|
| |
|
|
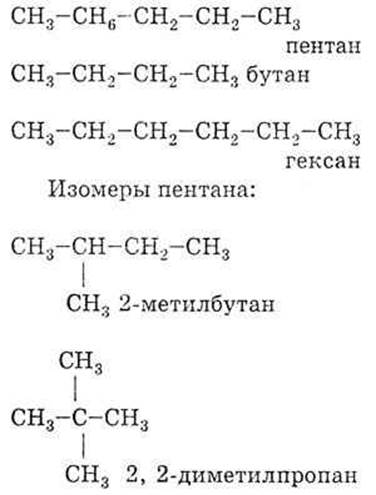
 Задача. Для вещества, имеющего строение СН3—СН2— СН2--СН2--СН3, приведите структурные формулы двух гомологов и двух изомеров. Назовите их по М.Н.
Решение. Гомологи:
Задача. Для вещества, имеющего строение СН3—СН2— СН2--СН2--СН3, приведите структурные формулы двух гомологов и двух изомеров. Назовите их по М.Н.
Решение. Гомологи:
 Задача. Какие из перечисленных низке соединений являются изомерами:
Задача. Какие из перечисленных низке соединений являются изомерами:
- а) 2-метил-гексан;
- б) 3-метилгептан;
- в) 3-этилгексан;
- г) 2, 2-диметил-гептан;
- д) 2, 4-диметилгексан;
- е) 2-метилоктан.
Подтвердите ответ, написав структурные формулы указанных веществ.
Решение.
 Задача. Сколько алкинов могут быть изомерны изопрену? Напишите структурные формулы этих алкинов и назовите их по М.Н.
Решение.
Задача. Сколько алкинов могут быть изомерны изопрену? Напишите структурные формулы этих алкинов и назовите их по М.Н.
Решение.
 Задача. Составьте уравнения реакций, посредством которых можно осуществить следующие превращения:
Задача. Составьте уравнения реакций, посредством которых можно осуществить следующие превращения:

|
| ЭТИЛОВЫЙ СПИРТ
|
| |
|
|
1. Классификация, строение, свойства.
Органические соединения, содержащие гидроксильную группу (ОН), связанную с атомом углерода, находящимся в состоянии sр3-гибридизации, называются одноатомными предельными спиртами.
Спирты можно классифицировать по составу в зависимости от числа ОН-групп и кратных связей:
Спирты
1. Одноатомные предельные:
С2Н5ОН этанол
2. Одноатомные непредельные:
 Для спиртов характерно да вида изомерии:
1. изомерия углеродного скелета;
2. изомерия положения гидроксильной группы.
Спирт, имеющий не менее двух атомов углерода, может образовать изомеры:
СН3 - СН2ОН этанол
СН3 - О - СН3 диметиловый эфир
В этаноле электроотрицательность атома кислорода более высокая, чем у атомов углерода и водорода и электронная плотность смещается в сторону гидроксилыюй группы, в результате чего углерод радикала получает частичный положительный заряд. Однако полярность связи С—О невелика. Схематически это выражается:
Для спиртов характерно да вида изомерии:
1. изомерия углеродного скелета;
2. изомерия положения гидроксильной группы.
Спирт, имеющий не менее двух атомов углерода, может образовать изомеры:
СН3 - СН2ОН этанол
СН3 - О - СН3 диметиловый эфир
В этаноле электроотрицательность атома кислорода более высокая, чем у атомов углерода и водорода и электронная плотность смещается в сторону гидроксилыюй группы, в результате чего углерод радикала получает частичный положительный заряд. Однако полярность связи С—О невелика. Схематически это выражается:

|
| ФЕНОЛ
|
| |
|
|
Электронное строение молекулы
 Бензольное кольцо оттягивает электронную плотность от кислорода гидроксилыюй группы. В свою очередь кислород притягивает к себе электрон от водорода гидроксильчной группы. В результате водород отщепляется в растворе в виде катиона Н+:
Бензольное кольцо оттягивает электронную плотность от кислорода гидроксилыюй группы. В свою очередь кислород притягивает к себе электрон от водорода гидроксильчной группы. В результате водород отщепляется в растворе в виде катиона Н+:
 Фенол проявляет слабые кислотные свойства. Под влиянием группы ОН электронная плотность перераспределяется в бензольном кольце таким образом, что увеличивается у второго, четвертого и шестого , атомов углерода. В результате происходит замещение атомов водорода в орто- и пара- положениях.
Сходство свойств фенола с этиловым спиртом
Взаимодействие с Na:
Фенол проявляет слабые кислотные свойства. Под влиянием группы ОН электронная плотность перераспределяется в бензольном кольце таким образом, что увеличивается у второго, четвертого и шестого , атомов углерода. В результате происходит замещение атомов водорода в орто- и пара- положениях.
Сходство свойств фенола с этиловым спиртом
Взаимодействие с Na:
 Отличие фенола от этилового спирта по химическим свойствам
Реакция нейтрализации:
C8H5OH + NaOHH --> C8H5ONa + H20
фенолят натрия
Свойство бензольного ядра
Отличие фенола от этилового спирта по химическим свойствам
Реакция нейтрализации:
C8H5OH + NaOHH --> C8H5ONa + H20
фенолят натрия
Свойство бензольного ядра
 2,4,6-трибромфенол
Фенол можно отличить от этанола с помощью реакции с бромной водой: в результате образуется белый осадок трибромфенола:
2,4,6-трибромфенол
Фенол можно отличить от этанола с помощью реакции с бромной водой: в результате образуется белый осадок трибромфенола:
 Это качественная реакция на фенол.
Это качественная реакция на фенол.
|
| ВЗАИМНОЕ ВЛИЯНИЕ ГИДРОКСИГРУПП В МНОГОАТОМНЫХ СПИРТАХ
|
| |
|
|
Так как в глицерине три группы ОН, в отличие от одноатомных спиртов, химическая активность глицерина выше, чем одноатомных спиртов. В реакциях могут участвовать одна, две или все три гидроксигруппы. Так, при взаимодействии с галогеноводородами они могут замещаться последовательно, и в конечном итоге образуется тригалогенопроизводное:
 Глицерин взаимодействует с гидроксидами некоторых металлов, в том числе и меди (II), с образованием глицератов. Эта реакция используется для обнаружения многоатомных спиртов:
Глицерин взаимодействует с гидроксидами некоторых металлов, в том числе и меди (II), с образованием глицератов. Эта реакция используется для обнаружения многоатомных спиртов:

 Голубой осадок Cu(OH)2 растворяется и образуется ярко-синий раствор глицерата меди.
При взаимодействии глицерина с азотной кислотой в зависимости от ее количества образуются моно-, ди- и тринитраты:
Голубой осадок Cu(OH)2 растворяется и образуется ярко-синий раствор глицерата меди.
При взаимодействии глицерина с азотной кислотой в зависимости от ее количества образуются моно-, ди- и тринитраты:
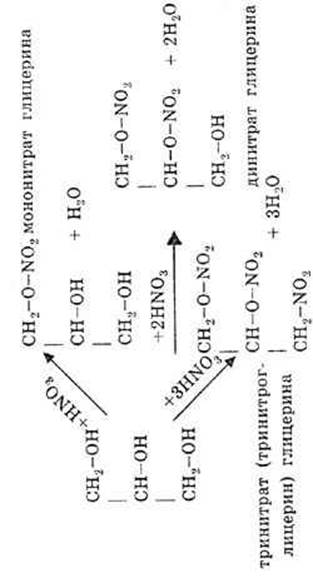
|
| ОРГАНИЧЕСКАЯ ХИМИЯ
|
| ТРЕТИЧНЫЙ СПИРТ
|
| |
|
|
Третичным называют спирт, в котором функциональная группа ОН связана с третичным углеродным атомом, например:
 Трехатомным называют спирт, в молекулах которого имеется три функциональных группы ОН. Например, глицерин:
Трехатомным называют спирт, в молекулах которого имеется три функциональных группы ОН. Например, глицерин:
 Задача. Исходя из электронного строения, опишите взаимное влияние атомов в молекуле этанола и фенола. Опытным путем докажите, как распознать фенол и этанол.
Решение:
Задача. Исходя из электронного строения, опишите взаимное влияние атомов в молекуле этанола и фенола. Опытным путем докажите, как распознать фенол и этанол.
Решение:
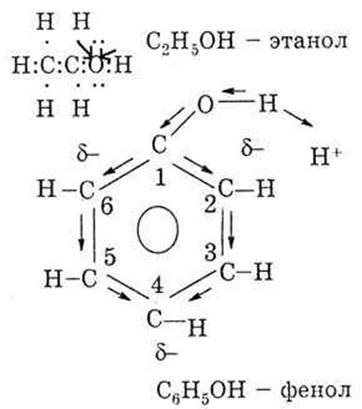 В этаноле электронная плотность смещена от радикала к группе ОН, поэтому она подвижна и может участвовать I в реакциях. В группе ОН водород отличается большей подвижностью, чем водород в радикале, так как связан с электроотрицательным атомом кислорода. Водород группы ОН может замещаться активным металлом. Так как влияние атомов взаимно, то группа ОН также влияет на радикал, поэтому атомы водорода радикала (рядом с функциональной группой) могут участвовать в реакциях замещения.
Фенол содержит тоже группу ОН, но она связана с бензольным кольцом. Электронная плотность смещается от группы ОН к бензольному кольцу, в результате увеличивается электронная плотность в орто- и пара-положениях. Поэтому, в отличие от бензола, в феноле замещаются три атома водорода у 2, 4, 6-углеродных атомов. Бензольное кольцо также влияет на группу ОН. В результате полного смещения электронной плоскости от водорода к кислороду, водород легче отщепляется в растворе в виде протона Н+. Поэтому фенол, в отличие от этанола, проявляет более сильные кислотные свойства.
В этаноле электронная плотность смещена от радикала к группе ОН, поэтому она подвижна и может участвовать I в реакциях. В группе ОН водород отличается большей подвижностью, чем водород в радикале, так как связан с электроотрицательным атомом кислорода. Водород группы ОН может замещаться активным металлом. Так как влияние атомов взаимно, то группа ОН также влияет на радикал, поэтому атомы водорода радикала (рядом с функциональной группой) могут участвовать в реакциях замещения.
Фенол содержит тоже группу ОН, но она связана с бензольным кольцом. Электронная плотность смещается от группы ОН к бензольному кольцу, в результате увеличивается электронная плотность в орто- и пара-положениях. Поэтому, в отличие от бензола, в феноле замещаются три атома водорода у 2, 4, 6-углеродных атомов. Бензольное кольцо также влияет на группу ОН. В результате полного смещения электронной плоскости от водорода к кислороду, водород легче отщепляется в растворе в виде протона Н+. Поэтому фенол, в отличие от этанола, проявляет более сильные кислотные свойства.
|
| УКСУСНЫЙ АЛЬДЕГИД
|
| |
|
|
Электронное строение карбонила
Атом углерода в карбони-ле находится в sр2-гибридизации. В результате образуются три —> связи. Такие связи лежат в одной плоскости и углы между ними 120°. Негибридизованное облако р-электрона углерода и облако р-электрона атома кислорода образуют  -связь. Двойная связь между углеродом и кислородом полярна, в отличие от этилена.
Основные химические свойства
Реакции присоединения по месту разрыва -связь. Двойная связь между углеродом и кислородом полярна, в отличие от этилена.
Основные химические свойства
Реакции присоединения по месту разрыва  -связи: -связи:
 Реакции окисления:
Реакция «серебряного зеркала»
Реакции окисления:
Реакция «серебряного зеркала»
 Реакция «медного зеркала»
Реакция «медного зеркала»
 Реакции «серебряного» и «медного зеркала» используются как качественные для распознания альдегидов.
Реакции «серебряного» и «медного зеркала» используются как качественные для распознания альдегидов.
|



 б) Этилен С2Н4 горит, но в отличие от этана, светящимся пламенем, так как имеет повышенное содержание углерода:
б) Этилен С2Н4 горит, но в отличие от этана, светящимся пламенем, так как имеет повышенное содержание углерода:
 Ацетилен С2Н2 горит коптящим пламенем, так как имеет большой процент углерода в молекуле:
Ацетилен С2Н2 горит коптящим пламенем, так как имеет большой процент углерода в молекуле:
 Для этилена и ацетилена характерны реакции присоединения и окисления, так как они содержат двойную и тройную связи.
Для этилена и ацетилена характерны реакции присоединения и окисления, так как они содержат двойную и тройную связи.
 Если условно обозначить окислитель атомом кислорода, то
Если условно обозначить окислитель атомом кислорода, то
 При этом раствор перманганата калия обесцвечивается.
При этом раствор перманганата калия обесцвечивается.
 Линейная полимеризация ацетилена:
СН=СН+СН=СН-->СН2=СН-С =СН (винилацетилен)
Циклическая полимеризация ацетилена:
Линейная полимеризация ацетилена:
СН=СН+СН=СН-->СН2=СН-С =СН (винилацетилен)
Циклическая полимеризация ацетилена:


 Практическое значение имеют диеновые, в молекулах которых двойные связи разделены простой (одинарной) связью. Это: бутадиен — 1,3 (дивинил) СН2=СН-СН=СН2и 2-метилбутадиен —1,3 (изопрен)
Практическое значение имеют диеновые, в молекулах которых двойные связи разделены простой (одинарной) связью. Это: бутадиен — 1,3 (дивинил) СН2=СН-СН=СН2и 2-метилбутадиен —1,3 (изопрен)
 в) особенности химических свойств, подтвердив уравнениями реакций с водородом, бромом, бромоводородом.
Особенность диеновых углеводородов в том, что присоединение происходит по концам цепи, а между вторым и третьим атомами углерода образуется двойная связь:
в) особенности химических свойств, подтвердив уравнениями реакций с водородом, бромом, бромоводородом.
Особенность диеновых углеводородов в том, что присоединение происходит по концам цепи, а между вторым и третьим атомами углерода образуется двойная связь:

 Это свободно-радикальный механизм.
Это свободно-радикальный механизм.
 В результате на плоскости образуются три сигма-связи с атомами углерода и водорода. ( Шесть р-электронов, которые не участвовали в гибридизации, образуют общее 6р-электронное облако, которое стягивает бензольное кольцо, делая его более прочным, так как в результате перекрывания возникает единая делокализованная шестиэлектронная
В результате на плоскости образуются три сигма-связи с атомами углерода и водорода. ( Шесть р-электронов, которые не участвовали в гибридизации, образуют общее 6р-электронное облако, которое стягивает бензольное кольцо, делая его более прочным, так как в результате перекрывания возникает единая делокализованная шестиэлектронная  -система (4n + 2 = 6, где n = 1).
Электронная плотность —> связи равномерно распределена по всему циклу, что приводит к выравненности длин связей С—С (0,1397 нм). Однозамещенные бензола не имеют изомеров.
-система (4n + 2 = 6, где n = 1).
Электронная плотность —> связи равномерно распределена по всему циклу, что приводит к выравненности длин связей С—С (0,1397 нм). Однозамещенные бензола не имеют изомеров.
 Основные химические свойства.
Реакции замещения:
Основные химические свойства.
Реакции замещения:
 Задача. В каком направлении пойдет реакция толуола с бромом:
Задача. В каком направлении пойдет реакция толуола с бромом:
 б) При освещении замещение произойдет в метильной группе:
б) При освещении замещение произойдет в метильной группе:
 Это объясняется взаимным влиянием бензольного кольца и заместителя.
Задача. Приведите примеры реакций, показывающих сходство бензола:
Это объясняется взаимным влиянием бензольного кольца и заместителя.
Задача. Приведите примеры реакций, показывающих сходство бензола:
 Сходство с непредельными углеводородами — реакции присоединения (хлора или водорода):
Сходство с непредельными углеводородами — реакции присоединения (хлора или водорода):
 гексахлор-циклогексан
Реакции замещения идут у бензола легче, чем у предельных углеводородов, а реакции присоединения — труднее, чем у непредельных.
Задача. Напишите уравнения химических синтезов, используя схему:
гексахлор-циклогексан
Реакции замещения идут у бензола легче, чем у предельных углеводородов, а реакции присоединения — труднее, чем у непредельных.
Задача. Напишите уравнения химических синтезов, используя схему:
 Укажите условия реакций.
Решение.
Укажите условия реакций.
Решение.

 Задача. У каких из приведенных ниже соединений возможна цистрансизомерия?
1. а) бутена-1, б) пентена-2, 3) 2-метилбутена-2, г) 2-метил-пропена, д) олеиновой кислоты, е) изопренового каучука.
2. Приведите структурные формулы цис-, трансизомеров.
3. Чем объясняется наличие цис-, трансизомерии у веществ?
Решение.
1) а), в), г) не имеют, б), д), е) имеют цис-, трансизомеры:
Задача. У каких из приведенных ниже соединений возможна цистрансизомерия?
1. а) бутена-1, б) пентена-2, 3) 2-метилбутена-2, г) 2-метил-пропена, д) олеиновой кислоты, е) изопренового каучука.
2. Приведите структурные формулы цис-, трансизомеров.
3. Чем объясняется наличие цис-, трансизомерии у веществ?
Решение.
1) а), в), г) не имеют, б), д), е) имеют цис-, трансизомеры:

 цис-форма изопренового каучука
цис-форма изопренового каучука
 транс-форма изопренового каучука
3) Наличие цис-, трансизомерии объясняется отсутствием свободного вращения молекулы относительно двойной связи. Оно затруднено, потому что молекула в этом месте имеет плоскостное строение (sр2-гибридизация двух атомов углерода, образующих двойную связь).
Необходимым условием для наличия цис-, трансизомеров является также наличие разных заместителей у атомов углерода, образующих двойную связь.
транс-форма изопренового каучука
3) Наличие цис-, трансизомерии объясняется отсутствием свободного вращения молекулы относительно двойной связи. Оно затруднено, потому что молекула в этом месте имеет плоскостное строение (sр2-гибридизация двух атомов углерода, образующих двойную связь).
Необходимым условием для наличия цис-, трансизомеров является также наличие разных заместителей у атомов углерода, образующих двойную связь.
 Получение хлорвинила, полимеризация его в полихлорвинил (плащи, клеенки, трубы, изоляция провода):
Получение хлорвинила, полимеризация его в полихлорвинил (плащи, клеенки, трубы, изоляция провода):
 Получение винилацетилена реакцией димеризации и на его основе - хлоропренового каучука:
Получение винилацетилена реакцией димеризации и на его основе - хлоропренового каучука:
 С Получение бензола тримеризацией ацетилена по методу Н.Д. Зелинского:
С Получение бензола тримеризацией ацетилена по методу Н.Д. Зелинского:
 Получение акрилонитрила и его полимеризация в полиакрилонитрил (синтетическое волокно нитрон):
Получение акрилонитрила и его полимеризация в полиакрилонитрил (синтетическое волокно нитрон):
 Для бутена-2 хара
Для бутена-2 хара  ктерны цис-, трансизомеры:
ктерны цис-, трансизомеры:
 При всех реакциях образуются высокомолекулярные вещества — полимеры из низкомолекулярных — мономеров. Реакции идут по месту разрыва
При всех реакциях образуются высокомолекулярные вещества — полимеры из низкомолекулярных — мономеров. Реакции идут по месту разрыва  -связей.
Реакция полимеризации: соединяются сразу много мономеров, побочных продуктов не образуется.
Реакция поликонденсации: соединяются постепенно разные мономеры с образованием побочных продуктов реакции.
Реакция сополимеризации: происходит одновременно и присоединение, и полимеризация разных мономеров.
2)
-связей.
Реакция полимеризации: соединяются сразу много мономеров, побочных продуктов не образуется.
Реакция поликонденсации: соединяются постепенно разные мономеры с образованием побочных продуктов реакции.
Реакция сополимеризации: происходит одновременно и присоединение, и полимеризация разных мономеров.
2)
 д) полимеризация
д) полимеризация



 Задача. Изобразите структурные формулы изомеров, имеющих молекулярную формулу С5Н8 и назовите их по международной номенклатуре.
Решение: С5Н8
Задача. Изобразите структурные формулы изомеров, имеющих молекулярную формулу С5Н8 и назовите их по международной номенклатуре.
Решение: С5Н8
 Задача. Сколько изомеров могут соответствовать эмпирической формуле СГ)НК1? Напишите структурные формулы этих изомеров и назовите их.
Решение. С5Н8
Задача. Сколько изомеров могут соответствовать эмпирической формуле СГ)НК1? Напишите структурные формулы этих изомеров и назовите их.
Решение. С5Н8

 Задача. Для вещества, имеющего строение СН3—СН2— СН2--СН2--СН3, приведите структурные формулы двух гомологов и двух изомеров. Назовите их по М.Н.
Решение. Гомологи:
Задача. Для вещества, имеющего строение СН3—СН2— СН2--СН2--СН3, приведите структурные формулы двух гомологов и двух изомеров. Назовите их по М.Н.
Решение. Гомологи:
 Задача. Какие из перечисленных низке соединений являются изомерами:
Задача. Какие из перечисленных низке соединений являются изомерами:
 Задача. Сколько алкинов могут быть изомерны изопрену? Напишите структурные формулы этих алкинов и назовите их по М.Н.
Решение.
Задача. Сколько алкинов могут быть изомерны изопрену? Напишите структурные формулы этих алкинов и назовите их по М.Н.
Решение.
 Задача. Составьте уравнения реакций, посредством которых можно осуществить следующие превращения:
Задача. Составьте уравнения реакций, посредством которых можно осуществить следующие превращения:

 Для спиртов характерно да вида изомерии:
1. изомерия углеродного скелета;
2. изомерия положения гидроксильной группы.
Спирт, имеющий не менее двух атомов углерода, может образовать изомеры:
СН3 - СН2ОН этанол
СН3 - О - СН3 диметиловый эфир
В этаноле электроотрицательность атома кислорода более высокая, чем у атомов углерода и водорода и электронная плотность смещается в сторону гидроксилыюй группы, в результате чего углерод радикала получает частичный положительный заряд. Однако полярность связи С—О невелика. Схематически это выражается:
Для спиртов характерно да вида изомерии:
1. изомерия углеродного скелета;
2. изомерия положения гидроксильной группы.
Спирт, имеющий не менее двух атомов углерода, может образовать изомеры:
СН3 - СН2ОН этанол
СН3 - О - СН3 диметиловый эфир
В этаноле электроотрицательность атома кислорода более высокая, чем у атомов углерода и водорода и электронная плотность смещается в сторону гидроксилыюй группы, в результате чего углерод радикала получает частичный положительный заряд. Однако полярность связи С—О невелика. Схематически это выражается:

 Бензольное кольцо оттягивает электронную плотность от кислорода гидроксилыюй группы. В свою очередь кислород притягивает к себе электрон от водорода гидроксильчной группы. В результате водород отщепляется в растворе в виде катиона Н+:
Бензольное кольцо оттягивает электронную плотность от кислорода гидроксилыюй группы. В свою очередь кислород притягивает к себе электрон от водорода гидроксильчной группы. В результате водород отщепляется в растворе в виде катиона Н+:
 Фенол проявляет слабые кислотные свойства. Под влиянием группы ОН электронная плотность перераспределяется в бензольном кольце таким образом, что увеличивается у второго, четвертого и шестого , атомов углерода. В результате происходит замещение атомов водорода в орто- и пара- положениях.
Сходство свойств фенола с этиловым спиртом
Взаимодействие с Na:
Фенол проявляет слабые кислотные свойства. Под влиянием группы ОН электронная плотность перераспределяется в бензольном кольце таким образом, что увеличивается у второго, четвертого и шестого , атомов углерода. В результате происходит замещение атомов водорода в орто- и пара- положениях.
Сходство свойств фенола с этиловым спиртом
Взаимодействие с Na:
 Отличие фенола от этилового спирта по химическим свойствам
Реакция нейтрализации:
C8H5OH + NaOHH --> C8H5ONa + H20
фенолят натрия
Свойство бензольного ядра
Отличие фенола от этилового спирта по химическим свойствам
Реакция нейтрализации:
C8H5OH + NaOHH --> C8H5ONa + H20
фенолят натрия
Свойство бензольного ядра
 2,4,6-трибромфенол
Фенол можно отличить от этанола с помощью реакции с бромной водой: в результате образуется белый осадок трибромфенола:
2,4,6-трибромфенол
Фенол можно отличить от этанола с помощью реакции с бромной водой: в результате образуется белый осадок трибромфенола:
 Это качественная реакция на фенол.
Это качественная реакция на фенол.
 Глицерин взаимодействует с гидроксидами некоторых металлов, в том числе и меди (II), с образованием глицератов. Эта реакция используется для обнаружения многоатомных спиртов:
Глицерин взаимодействует с гидроксидами некоторых металлов, в том числе и меди (II), с образованием глицератов. Эта реакция используется для обнаружения многоатомных спиртов:

 Голубой осадок Cu(OH)2 растворяется и образуется ярко-синий раствор глицерата меди.
При взаимодействии глицерина с азотной кислотой в зависимости от ее количества образуются моно-, ди- и тринитраты:
Голубой осадок Cu(OH)2 растворяется и образуется ярко-синий раствор глицерата меди.
При взаимодействии глицерина с азотной кислотой в зависимости от ее количества образуются моно-, ди- и тринитраты:

 Трехатомным называют спирт, в молекулах которого имеется три функциональных группы ОН. Например, глицерин:
Трехатомным называют спирт, в молекулах которого имеется три функциональных группы ОН. Например, глицерин:
 Задача. Исходя из электронного строения, опишите взаимное влияние атомов в молекуле этанола и фенола. Опытным путем докажите, как распознать фенол и этанол.
Решение:
Задача. Исходя из электронного строения, опишите взаимное влияние атомов в молекуле этанола и фенола. Опытным путем докажите, как распознать фенол и этанол.
Решение:
 В этаноле электронная плотность смещена от радикала к группе ОН, поэтому она подвижна и может участвовать I в реакциях. В группе ОН водород отличается большей подвижностью, чем водород в радикале, так как связан с электроотрицательным атомом кислорода. Водород группы ОН может замещаться активным металлом. Так как влияние атомов взаимно, то группа ОН также влияет на радикал, поэтому атомы водорода радикала (рядом с функциональной группой) могут участвовать в реакциях замещения.
Фенол содержит тоже группу ОН, но она связана с бензольным кольцом. Электронная плотность смещается от группы ОН к бензольному кольцу, в результате увеличивается электронная плотность в орто- и пара-положениях. Поэтому, в отличие от бензола, в феноле замещаются три атома водорода у 2, 4, 6-углеродных атомов. Бензольное кольцо также влияет на группу ОН. В результате полного смещения электронной плоскости от водорода к кислороду, водород легче отщепляется в растворе в виде протона Н+. Поэтому фенол, в отличие от этанола, проявляет более сильные кислотные свойства.
В этаноле электронная плотность смещена от радикала к группе ОН, поэтому она подвижна и может участвовать I в реакциях. В группе ОН водород отличается большей подвижностью, чем водород в радикале, так как связан с электроотрицательным атомом кислорода. Водород группы ОН может замещаться активным металлом. Так как влияние атомов взаимно, то группа ОН также влияет на радикал, поэтому атомы водорода радикала (рядом с функциональной группой) могут участвовать в реакциях замещения.
Фенол содержит тоже группу ОН, но она связана с бензольным кольцом. Электронная плотность смещается от группы ОН к бензольному кольцу, в результате увеличивается электронная плотность в орто- и пара-положениях. Поэтому, в отличие от бензола, в феноле замещаются три атома водорода у 2, 4, 6-углеродных атомов. Бензольное кольцо также влияет на группу ОН. В результате полного смещения электронной плоскости от водорода к кислороду, водород легче отщепляется в растворе в виде протона Н+. Поэтому фенол, в отличие от этанола, проявляет более сильные кислотные свойства.
 Реакции окисления:
Реакция «серебряного зеркала»
Реакции окисления:
Реакция «серебряного зеркала»
 Реакция «медного зеркала»
Реакция «медного зеркала»
 Реакции «серебряного» и «медного зеркала» используются как качественные для распознания альдегидов.
Реакции «серебряного» и «медного зеркала» используются как качественные для распознания альдегидов.
