
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Сложные эфиры азотной кислоты
|
|
Общая формула этой группы лекарственных веществ R–O–NO2. Нитроглицерин впервые синтезирован А. Собреро в 1846 г, а его производство налажено А. Нобелем в 60-70-х гг 19 в.
Получают нитроглицерин, используя реакцию этерификации. Исходными продуктами синтеза служат глицерин, азотная кислота и концентрированная серная кислота (дегидратирующее средство).
Нитроглицерин синтезируют при –15°C, пропуская (тонкой струей) безводный глицерин через смесь концентрированных серной и азотной кислот (1:1):
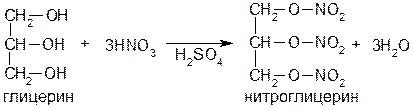
Ввиду высокой взрывоопасности современные процессы его производства проводят с помощью дистанционного контроля и автоматического управления. Нитрование выполняют в инжекторе, а отделение от кислот и промывку — в центрифуге малыми порциями.
Нитроглицерин представляет собой маслянистую жидкость (табл. 25.2). Он растворим в этаноле и в других органических растворителях, а в воде мало растворим.
25.2. Свойства нитроглицерина
| Лекарственное вещество | Химическая структура | Описание |
| Nitroglycerin— нитроглицерин |
 тринитрат глицерина
тринитрат глицерина
| Бесцветное или бледно-желтое масло. Плотность не более 0,829 г/см3 |
В медицине применяют раствор нитроглицерина 1%, представляющий собой бесцветную прозрачную жидкость.
Подлинность нитроглицерина устанавливают по нитрат-ионам, которые образуются при гидролизе. Используют в качестве реактива раствор дифениламина, который нитратами окисляется до имониевой соли дифенилбензидина, имеющей голубую окраску (см. ч. II, гл. 13).
Для обнаружения нитрогруппы в нитроглицерине (как и в других сложных эфирах азотной кислоты) можно использовать реакцию ее восстановления до нитритов, которые затем открывают реакцией Грисса. Нитроглицерин вначале смешивают с сульфаниловой кислотой и a-нафтиламином, растворенным в 30%-ной уксусной кислоте, а затем добавляют цинковую пыль. В результате реакции нитрогруппа восстанавливается до нитрит-иона и образуется диазосоединение, которое взаимодействуя с α-нафтиламином превращается в азокраситель красного цвета.
При действии на нитроглицерин анилином и серной кислотой появляется пурпурно-красное окрашивание, после добавления воды переходящее в зелёное.
Спиртовую часть молекулы идентифицируют у нитроглицерина после омыления раствором гидроксида натрия. Выделившийся глицерин нагревают с гидросульфатом калия. Образуется акролеин, обладающий характерным острым запахом:
 |
Спиртовой компонент молекулы нитроглицерина может быть обнаружен реакцией бензоилирования (образования эфиров бензойной кислоты после обработки хлористым бензоилом). Образовавшийся трибензоат глицерина имеет температуру плавления 76 °C.
Количественно определить содержание нитроглицерина можно с помощью реакции омыления, которую выполняют в присутствии окислителя (пероксида водорода). Один моль нитроглицерина реагирует с пятью молями гидроксида натрия. Три из них идут на омыление, а две расходуются на нейтрализацию образующихся муравьиной и уксусной кислот:
H2O2
C3H5(ONO2)3 + 5NaOH ¾¾® NaNO3 + 2NaNO2 + CH3COONa + HCOONa + 3H2O
Методика фотометрического определения нитроглицерина в лекарственных формах основана на измерении светопоглощения (при длине волны 410 нм) продукта взаимодействия с фенол-2,4-дисульфокислотой. Содержание нитроглицерина устанавливают с помощью калибровочного графика, построенного при измерении светопоглощения в тех же условиях реактива с химически чистым нитратом калия. Нитраты с фенол-2,4-дисульфокислотой в аммиачной среде образуют окрашенную в желтый цвет орто-хиноидную форму 6-нитрофенол-2,4-дисульфокислоты:
|
|
|

Проведенными исследованиями (А.И. Гризодуб, Н.А. Казаринов) показано, что таблетки нитроглицерина недостаточно стабильны при хранении. Основные причины нестабильности — возгонка нитроглицерина и поглощение его укупоривающей ватой, а также миграция из таблетки в таблетку. Методами ТСХ, ГЖХ и ИК-спектроскопии установлено, что наряду с нитроглицерином его лекарственные формы содержат примеси мононитроглицерина (I), динитроглицерина (II) и диэтиленгликольдинитрата (III):

В результате проведенных исследований разработаны и включены в ФС на 1%-ные растворы и таблетки нитроглицерина (по 0,0005 г) способы испытаний на наличие примесей I, II и III веществ с использованием метода ТСХ на пластинках «Силуфол» или АТСХ с люминофором УФ-254. После хроматографирования и проявления хроматограмм на них должны быть видны пятно нитроглицерина (соответствующее стандартному образцу) и пятна каждой из указанных трёх примесей (не более 1% каждой и не более 2% в суммарном содержании).
Лекарственные препараты нитроглицерина хранят по списку Б небольшими количествами в хорошо укупоренной таре, в прохладном, защищенном от света месте, вдали от огня. При хранении нитроглицерина следует соблюдать большую осторожность, так как от удара или при нагревании до 180°C он взрывается вследствие образования большого количества газов:
4C3H5(ONO2)3 ¾® 6N2 + 12CO2 + O2 + 10H2O
Поэтому пролитый нитроглицерин нужно сразу же залить раствором гидроксида калия, при этом происходит реакция омыления:
C3H5(ONO2)3 + 3KOH ¾® C3H5(OH)3 + 3KNO3
В растворах кислот гидролиз идёт медленнее, ещё медленнее в воде.
Соприкосновение нитроглицерина или его растворов (даже в малых количествах) с кожей и слизистой оболочкой может вызвать сильные головные боли, поэтому при работе с растворами нитроглицерина следует соблюдать осторожность.
Нитроглицерин применяют в качестве антиангинального, гипотензивного и спазмолитического (коронарорасширяющего) средства. В последние годы было установлено, что нитроглицерин и другие эфиры азотной кислоты являются пролекарствами, которые в организме превращаются в нитрат-ионы. Они восстанавливаются гемоглобином крови и железосодержащими ферментами в монооксид азота:
NO3– + 3Fe2+ + 4H+ ¾® NO + 3Fe3+ + 2H2O
Монооксид азота расслабляет гладкие мышцы сосудов, снижая кровяное давление, снимая ишемические боли сердца. За это открытие ученым была в 1998 г. присуждена Нобелевская премия.
Многочисленные лекарственные формы нитроглицерина классифицируют на следующие группы: применяемые сублингвально (спиртовой 1%-ный раствор, таблетки по 0,0005 г, капсулы, содержащие 0,005 или 0,001 г 1%-ного раствора); длительно действующие пероральные лекарственные формы (сустак-мите, сустак-форте, содержащие соответственно 2,6 и 6,4 мг нитроглицерина, нитронг — 2,6 и 6,5 мг, нитромак — 2,5 и 6,5 мг); буккальный нитроглицерин (тринитролонг по 1 или 2 мг); ингаляционные лекарственные формы (аэрозоль), содержащие нитроглицерин в сочетании с ментолом, нормализующим тонус мозговых вен; нитроглицерин для внутривенных инъекций (ампулированный 0,1%-ный раствор в изотоническом растворе глюкозы); лекарственные формы для трансдермального применения (мази — нитродерм, нитрофур, нитродиск и др., пластыри, полоски, диски).
ГЛАВА 26.
|
Просмотров 4411 |
|
|
