
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Определение температуры кипения
|
|
Над всеми жидкостями в результате их испарения устанавливается равновесие между жидкостью и паром, а следовательно, и определенное давление пара. Величина этого давления зависит от природы жидкости и от температуры. С повышением температуры увеличивается кинетическая энергия молекул в жидкости, все большее их количество способно перейти в газовую фазу и следовательно, давление пара над жидкостью возрастает (рисунок 4).

Рисунок 4 – Кривая давления водяного пара
Температуру, при которой давление пара становится равным внешнему давлению, называют температурой кипения.Точка пересечения (рисунок 4) горизонтальной прямой, отвечающей давлению 760 мм рт. ст., и кривой давления пара соответствует температуре кипения при нормальном давлении. Любая жидкость, не разлагающаяся при нагревании до температуры, при которой давление пара становится равным 760 мм рт. ст., имеет свою характерную температуру кипения при нормальном атмосферном давлении. На рисунке 4 видно также, что при давлении 200 мм рт. ст. вода кипела бы приблизительно при 66 °С. Эту зависимость температуры кипения от давления используют в лабораторной практике и промышленности для перегонки без разложения веществ, кипящих при высоких температурах (вакуумная перегонка). В ряде справочных и учебных пособий приведены номограммы, позволяющие связать между собой температуры кипения при атмосферном давлении и в вакууме, т. е. определить то максимальное остаточное давление, которое должно быть в перегонной установке, чтобы вещество перегонялось ниже температуры его разложения (см., например, /3, с. 32/).
Этой же цели (очистка высококипящих веществ) служат и другие модификации перегонки. Например, перегонка с водяным паром позволяет перегнать высококипящее вещество при атмосферном давлении, однако давление паров над поверхностью жидкости, равное атмосферному, складывается из суммы парциальных давлений самого вещества и паров воды. Водяной пар в этом способе продувают (барботируют) через толщу вещества в перегонном кубе.
В большинстве случаев определение температуры кипения производится при перегонке вещества в процессе его очистки. В случае необходимости определение температуры кипения малого количества жидкости можно пользоваться микрометодом Сиволобова (рисунок 6).
Для его проведения можно использовать стандартный прибор для определения температуры плавления, описанный выше (рисунок 5). В запаянную с одного конца тонкостенную стеклянную трубку (6) – диаметр ~ 3 мм – помещают каплю жидкости. В трубку опускают капилляр (4), запаянный с верхнего конца, прикрепляют трубку к термометру резинкой (5) и нагревают в приборе до тех пор, пока из капилляра не начнут выходить пузырьки непрерывной струей. Отмечают температуру, при которой началось непрерывное выделение пузырьков. Она соответствует температуре кипения жидкости. Обязательно записывают атмосферное давление по барометру. По значению температуры кипения можно вещество идентифицировать и определить его чистоту.

|  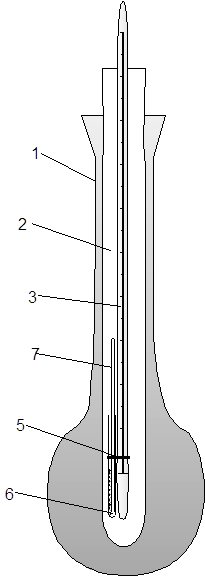
|
| 1 – внешняя стеклянная колба; 2 – внутренняя пробирка; 3 – термометр; 4 – капилляр с веществом; 5 – резиновое колечко; 6 – трубка с исследуемой жидкостью; 7 – запаянный капилляр | |
| Рисунок 5 – прибор для определения температуры плавления | Рисунок 6 – Прибор для определения температуры кипения (по Сиволобову) |
2 Определение молекулярной рефракции
органических соединений
Если монохроматический свет проходит через границу раздела двух различных сред (рисунок 7), то он отклоняется по закону Снеллиуса:

Константа n называется относительным показателем (или коэффициентом) преломления второго вещества по отношению к первому. Волновая теория света устанавливает простую связь показателя преломления со скоростью распространения световых волн в двух средах С1 и С2 :



a – угол падения; b – угол преломления
Рисунок 7 – Преломление луча монохроматического света
на границе раздела двух фаз
Показатель преломления по отношению к вакууму называется абсолютным показателем преломления. При измерении показателей преломления  жидких и твердых тел обычно определяют относительные показатели преломления по отношению к воздуху лабораторного помещения.
жидких и твердых тел обычно определяют относительные показатели преломления по отношению к воздуху лабораторного помещения.
Показатель преломления вещества определяется его природой, но зависит также от внешних условий – температуры и длины волны света. У органических жидкостей с ростом температуры на 1° он падает на 4·10–4-5 · 10–4. Температуру указывают надстрочным индексом, а длину волны – подстрочным индексом справа. Вместо числовых значений длин волн часто употребляемых спектральных линий обычно указывают их буквенное обозначение. Так, например:
 ;
;  ;
; 
обозначают показатели преломления при 20, 25, и 18,5 °С для D линии спектра натрия (589,3 нм) и линий α и β водорода; соответственно (β = 486,1 нм, α = 656,3 нм) спектров испускания. Наиболее часто показатель преломления дается для спектральной линии 589,3 нм (D-линия) в спектре натрия, т.е.  .
.
Показатель преломления характеризует поляризуемость молекулы, под которой понимают способность ее к поляризации, т. е. к изменению состояния электронного облака под действием внешнего электрического поля. По мере возрастания поляризуемости молекулы возрастает n, и эта величина связана с молекулярной рефракцией МR по уравнению Лорентц-Лоренца:
 ,
,
где n – показатель преломления вещества или раствора;
М – молекулярная масса вещества;
d- удельная масса вещества (плотность).
В отличие от показателя преломления молекулярная рефракция не зависит от температуры.
В электромагнитном поле видимого света поляризуемость молекул практически целиком обусловлена смещением электронов и равна сумме эффектов смещений отдельных электронов. Последнее обстоятельство придает МR химических соединений характер аддитивной константы. Она может быть определена теоретически как сумма рефракций отдельных атомов, входящих в состав молекулы с учетом добавок (инкрементов), учитывающих наличие и количество кратных связей:
MRтеор. = Σ ARат. + Σ ink. ,
где ARат. – атомная рефракция одного атома;
ink – инкремент одной связи.
Величины АR для отдельных атомов и инкременты кратных связей известны и приведены в большинстве соответствующих пособий и справочников
/5, с. 17/ (таблица 1). Зная предположительную структурную формулу соединения, можно рассчитать для него МRтеор. как сумму АRат.
Например, для изопропилбензола (кумола) MRтеор. равна:
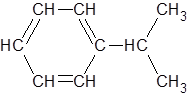
MRтеор. = ARC · 9 + ARH · 12 + inkдв. св. · 3
Подставляя соответствующие значения AR и ink (таблица 1), получаем:
MRтеор. = 2,418 ∙ 9 + 1,100 ∙ 12 + 1,733 ∙ 3 = 40,161
Таблица 1 – Атомные рефракции отдельных атомов и инкременты
| Атом | ARат. | Атом | ARат. |
| Водород (H) | 1,100 | Азот (N): | |
| Углерод (C) | 2,418 | аминный: | |
| Кислород (O): | первичный | 2,328 | |
| эфирный | 1,643 | вторичный | 2,502 |
| гидроксильный | 1,525 | третичный | 2,840 |
| карбонильный | 2,211 | нитрильный | 3,118 |
| Хлор (Cl) | 5,967 | Инкремент двойной связи | 1,733 |
| при карбонильной группе | 6,336 | Инкремент тройной связи | 2,336 |
| Иод (I) | 13,900 | Нитрогруппа в бензольном | 7,7 |
| Бром (Br) | 8,865 | ядре |
На практике МRэкс неизвестного вещества определяют по формуле
Лорентц-Лоренца (см. выше) и сравнивают с рассчитанным значением МRтеор. При этом величину молекулярной массы М определяют специальными методами, например, по повышению температуры кипения раствора исследуемого вещества в определенном растворителе (эбуллиоскопическийметод) или по понижению температуры замерзания его раствора (криоскопическийметод)
/6, с. 255, 259/. Удельную массу (плотность) вещества (d) определяют чаще всего пикнометрическим методом /7, Т. 1, с. 116/.
Для определения величины показателя преломления используют специальный прибор – рефрактометр. Стандартным прибором для лабораторий органической химии служит рефрактометр Аббе. Он сконструирован таким образом, что при использовании полихроматического (солнечного или искусственного) света дает значение показателя преломления для D-линии натрия. Для измерения необходимо лишь несколько капель жидкости, точность измерения составляет ± 0,0001 единиц показателя преломления. Чтобы добиться такой точности, во время измерения следует поддерживать постоянную температуру с точностью до ± 0,2 °С (что достигается с помощью термостата). Показатель преломления целесообразно измерять при 20°С, а у низкоплавких твердых веществ – несколько выше температуры плавления.
Поскольку каждое вещество характеризуется своим значением показателя преломления, рефрактометрию совместно с другими методами можно использовать для идентификации (узнавания) веществ. Идентификация осуществляется на основе совпадения измеренного и справочного значений показателя преломления чистых веществ, найденных при одинаковых условиях. Ввиду того, что различные вещества могут иметь близкие значения показателей преломления, рефрактометрию обычно дополняют другими методами идентификации веществ (спектральные измерения, определение температуры плавления или кипения и др.). С помощью показателя преломления можно также судить о чистоте вещества. Расхождение в величинах измеренного и справочного (для чистого вещества) значений показателей преломления веществ, найденных в одинаковых условиях, указывает на присутствие в нем примесей. В тех случаях, когда в литературе отсутствуют сведения о физических константах веществ (в том числе и показателе преломления), его можно признать чистым только тогда, когда физические константы не изменяются в процессах повторной очистки. Наибольшую точность рефрактометрический структурный анализ дает для жидких веществ. При этом необходимо располагать данными о составе и молекулярной массе (брутто-формуле) или основаниями для предположения о структурной формуле вещества. Заключение о структуре вещества выносится на основании сравнения МRэксп , найденной по формуле Лорентц-Лоренца, и Мrтеор. Совпадение значений МRэксп и Мrтеор с точностью 0,3-0,4 подтверждает вероятность предполагаемой брутто-формулы и структуры. Расхождение Мrтеор Мrэксп. более чем на 0,3-0,4 единицы указывает на неправильность сделанных при подсчете МRтеор. предположений о строении и составе вещества. В этом случае необходимо рассмотреть другие возможные для данной брутто-формулы молекулярные структуры вещества.
Поскольку показатель преломления зависит от концентрации растворов, рефрактометрию используют также для определения их концентрации, для проверки чистоты веществ и контроля за процессами разделения, например, можно контролировать перегонку (в аналитических целях). Показатель преломления бинарной смеси линейно зависит от концентрации компонентов (в объемных процентах), если только при смешивании не происходит изменения объема. Если происходят отклонения от линейной зависимости, необходимо строить калибровочную кривую.
2.1 Методика измерения с использованием
рефрактометра Аббе
- Подключают измерительную головку рефрактометра к термостату. Для этого шланги, идущие от термостата, присоединияют к соответствующим штуцерам. Включают термостат и устанавливают (при необходимости) контактным термометром температуру +20°С (по термометру, установленному в головке прибора).
Примечание – Этот пункт методики выполняют по указанию преподавателя при проведении работы в рамках УИРС.
- Поднимают верхнюю половинку измерительной головки и отводят ее в крайнее (открытое) положение. Кусочком ваты, смоченной эфиром,
осторожно протирают нижнюю полированную и верхнюю матовую стеклянные призмы прибора. Дают эфиру испариться.
- Пипеткой или стеклянной палочкой осторожно наносят 2-3 капли исследуемого вещества на нижнюю полированную стеклянную призму измерительной головки.
- Острожно опускают (избегая удара) верхнюю половинку измерительной головки.
- Поворачивая в разных направлениях и плоскостях зеркальце с левой стороны корпуса рефрактометра, направляют поток света в окошко на корпусе; процесс контролируют, наблюдая в окуляр прибора.
- Не отрывая глаз от окуляра, вращают попеременно маховички на правой и левой сторонах прибора, выводя границу между светлым и темным полями в зону видимости.
- Маховичком на левой стороне корпуса добиваются максимальной резкости границы между светлым и темным полями
- Маховичком на правой стороне корпуса выводят эту границу на пересечение двух взаимно перпендикулярных диагональных прямых в поле видимости прибора (рисунок 8).
- На нижней шкале считывают значение показателя преломления.
Примечание: в зависимости от конструкции и класса прибора можно получить значения с четырьмия или пятью знаками после запятой; при этом в любом случае последний знак определяется приблизительно.
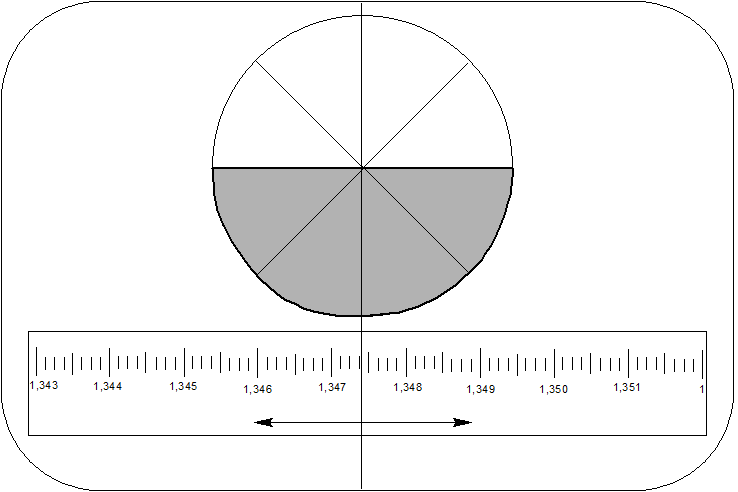
Рисунок 8 – Вид наблюдаемой картинки в окуляре рефрактометра
Контрольные вопросы
Перекристаллизация
1 Принципы подбора растворителя.
2 Какие Вы знаете полярные и неполярные растворители?
3 Расскажите, как практически проводится перекристаллизация.
4 Какие стадии включает в себя процесс перекристаллизации?
5 Предложите подходящие растворители для перекристаллизации м-динитробензола (Тпл = 90°С), п-нитрофенола (Тпл = 114°С), янтарной кислоты (Тпл = 183°С), п-толуидина (Тпл = 44°С), этилового эфира п-амино-бензойной кислоты (Тпл = 92°С) или других соединений, выданных преподавателем.
Возгонка
1 Какой процесс называется возгонкой и как он проводится?
2 Какие вещества и от каких примесей можно очистить возгонкой?
Экстракция
1 Для чего используется метод экстракции в органическом синтезе?
2 Каким требованиям должен удовлетворять растворитель, применяемый для экстракции?
3 Какие виды делительных воронок Вы знаете? Как следует подготовить к работе делительную воронку?
4 Как нужно проводить экстракцию, чтобы наиболее полно использовать имеющийся растворитель?
5 Как можно понизить растворимость в воде экстрагируемого вещества и растворителя?
6 Как можно разрушить эмульсию, образующуюся при встряхивании смесей в делительной воронке?
7 Как рекомендуется выливать водный раствор из делительной воронки и как – органический?
8 Как проводится экстракция твердых веществ? Принцип работы аппарата Сокслета.
|
Просмотров 2003 |
|
|
