
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ МОЛЯРНЫХ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
|
|
Методическое пособие
для выполнения лабораторных работ по физике
часть IV
Ф.И.О. студента___________________________________________
№ группы ________________________________________________
УКП ____________________________________________________
Ф.И.О. ведущего преподавателя _____________________________
_________________________________________________________
Лаб. работа №803 РАБОТА ЗАЧТЕНА
Лаб. работа №805 РАБОТА ЗАЧТЕНА
Лаб. работа №702 РАБОТА ЗАЧТЕНА
___________________________
Порядок выполнения работ
1. Лабораторные работы предназначены для проверки изучаемых физических законов на практике.
2. Номер работы, которую студент будет выполнять на следующем занятии, назначает преподаватель, проводящий лабораторные работы.
3. Экспериментальные и расчетные данные заносятся в журнал только с разрешения ведущего преподавателя. Все предварительные расчеты выполняются на черновике.
4. После выполнения работы преподаватель должен поставить отметку в журнале о том, что работа зачтена.
5. Студенты, не сдавшие в срок лабораторные работы, к экзамену не допускаются.
Лабораторная работа 8-03.
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ МОЛЯРНЫХ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ.
1. Цель работы: ознакомление с методом Клемана-Дезорма и определение отношения молярных теплоемкостей воздуха при постоянном давлении и постоянном объеме.
2. Теоретические основы. Теплоемкостью тела называется величина, равная количеству теплоты, необходимому для нагревания этого тела на один Кельвин. Она зависит от массы тела, его химического состава и вида процесса сообщения теплоты. Теплоемкость одного моля вещества называется молярной теплоемкостью сМ. Согласно первому началу термодинамики тепло δQ, сообщенное системе, расходуется на увеличение внутренней энергии системы dU и совершение системой работы δA против внешних сил δQ=dU+δA. (1)
При нагревании газа при постоянном объеме (dV=0) работа газа dA=рdV равна нулю, поэтому молярная теплоемкость
 , (2)
, (2)
где i – число степеней свободы – количество независимых координат, с помощью которых однозначно можно задать положение молекулы.
При изобарном нагревании (p=const) тепло, подведенное к газу, расходуется на увеличение внутренней энергии и на совершение работы расширения газа  . Теплоемкость моля газапри этом равна
. Теплоемкость моля газапри этом равна
 . (3)
. (3)
Сравнивая (2) и (3), получим  . (4)
. (4)
Уравнение (4) представляет собой уравнение Майера для молярных теплоемкостей.
Для идеальных газов отношение 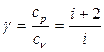 зависит только от числа степеней свободы молекул газа, которое в свою очередь определяется структурой молекулы, т.е. количеством атомов, из которых состоит молекула. Одноатомная молекула имеет три степени свободы (инертные газы). Если молекула состоит из двух атомов, то число степеней свободы складывается из числа степеней свободы поступательного движения центра масс и вращательного движения системы вокруг двух осей, перпендикулярных к оси молекулы, т.е. равно пяти. Для трех и многоатомных молекул имеются три поступательные и три вращательные степени свободы, т.е. i = 6.
зависит только от числа степеней свободы молекул газа, которое в свою очередь определяется структурой молекулы, т.е. количеством атомов, из которых состоит молекула. Одноатомная молекула имеет три степени свободы (инертные газы). Если молекула состоит из двух атомов, то число степеней свободы складывается из числа степеней свободы поступательного движения центра масс и вращательного движения системы вокруг двух осей, перпендикулярных к оси молекулы, т.е. равно пяти. Для трех и многоатомных молекул имеются три поступательные и три вращательные степени свободы, т.е. i = 6.
3. Экспериментальная часть
3.1. Краткое описание экспериментальной установки и оборудования.
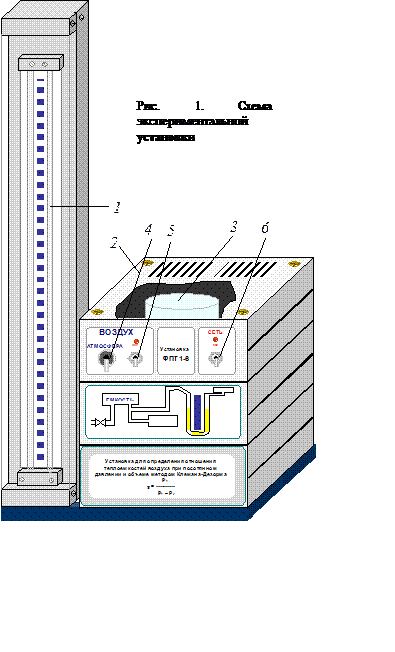 Схема экспериментальной установки представлена на рис.1: 1 – блок манометра; 2 – приборный блок; 3 – колба; 4 – пневмотумблер «АТМОСФЕРА»; 5 – тумблер включения насоса для подачи воздуха в колбу; 6 – тумблер включения питания установки.
Схема экспериментальной установки представлена на рис.1: 1 – блок манометра; 2 – приборный блок; 3 – колба; 4 – пневмотумблер «АТМОСФЕРА»; 5 – тумблер включения насоса для подачи воздуха в колбу; 6 – тумблер включения питания установки.
Если при помощи насоса накачать в сосуд некоторое количество воздуха, то давление и температура воздуха внутри сосуда повысятся. Вследствие теплообмена воздуха с окружающей средой через некоторое время температура воздуха, находящегося в сосуде, сравняется с температурой внешней среды  .
.
Давление, установившееся в сосуде, равно P1= P0+P’,где P0 – атмосферное давление, P’=h1k – добавочное давление, пропорциональное разности уровней жидкости в манометре h1(рис. 2), k – коэффициент пропорциональности. Таким образом, воздух внутри сосуда характеризуется параметрами P0+P’, V0, Т0. Уравнение состояния примет вид:
 , (6)
, (6)
где m – масса воздуха в сосуде, М – молярная масса воздуха.
 Если на короткое время (~3с) открыть тумблер «АТМОСФЕРА», то воздух в сосуде будет расширяться. Этот процесс расширения можно рассматривать как подключение к сосуду дополнительного объема V’. Давление в сосуде установится равным атмосферному Р0, температура понизится до Т1, а объем будет равен V0+V’. Следовательно, в конце процесса уравнение состояния примет вид
Если на короткое время (~3с) открыть тумблер «АТМОСФЕРА», то воздух в сосуде будет расширяться. Этот процесс расширения можно рассматривать как подключение к сосуду дополнительного объема V’. Давление в сосуде установится равным атмосферному Р0, температура понизится до Т1, а объем будет равен V0+V’. Следовательно, в конце процесса уравнение состояния примет вид
 . (7)
. (7)
Разделив выражение (7) на выражение (6), получим  . (8)
. (8)
Расширение происходит без теплообмена с внешней средой, т.е. процесс является адиабатическим, поэтому для начального и конечного состояния системы применимо соотношение
 или
или 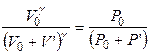 . (9)
. (9)
Охладившийся при расширении воздух через некоторое время, вследствие теплообмена с внешней средой, нагреется до комнатной температуры Т0 (изохорический процесс). Давление возрастет до некоторой величины P2= P0+P’’, где P’’=h2k – новое добавочное давление, пропорциональное разности уровней жидкости в манометре h2. Для воздуха массой m’ оставшегося в сосуде уравнение состояния начала нагрева  . (10)
. (10)
В конце нагрева до комнатной температуры Т0  . (11)
. (11)
Разделив (10) на (11), получим  . (12)
. (12)
Правые части выражений (8) и (12) одинаковы, следовательно, левые части также равны

 или
или 
 . (13)
. (13)
Возведя левую и правую часть (13) в степень g, запишем 
 . (14)
. (14)
Заменим правую часть (14) с учетом (9)  откуда
откуда  (15)
(15)
т.к.  то, ограничиваясь первым членом разложения в ряд бинома
то, ограничиваясь первым членом разложения в ряд бинома  и пренебрегая членами второго порядка малости, получим
и пренебрегая членами второго порядка малости, получим

 . (16)
. (16)
3.2. Методика проведения эксперимента.
3.2.1. Подать на установку питание, включив тумблер 6 «СЕТЬ».
3.2.2.Включить подачу воздуха в колбу тумблером «ВКЛ» в модуле «ВОЗДУХ». При этом пневмотумблер «АТМОСФЕРА» должен находиться в нижнем положении.
3.2.2. По манометру 1 контролировать рост давления в колбе. После достижения заданного уровня рабочего давления (150¸250) отключить подачу воздуха тумблером «ВКЛ».
3.2.4. После стабилизации давления (в течение 2-3 минут) снять показание h1 манометра 1. Результат занести в таблицу.
3.2.5. Переключить пневмотумблер «АТМОСФЕРА» в верхнее положение и держать его так до тех пор, пока давление в колбе не упадет до нуля, после чего резко опустить пневмотумблер вниз.
3.2.6. После стабилизации процесса (2-3 минуты), снять показания h2 манометра 1 определяющее давление, возросшее за счет теплообмена до комнатной температуры(?). Результат занести в таблицу.
3.2.7. Опыт провести 5 раз, изменяя величину h1.
3.3. Обработка результатов измерений.
3.3.1. Подставить в формулу (16) полученные значения h1 и h2, взятые из каждого отдельного опыта, вычислить g1, g2 и т.д. Результаты занести в таблицу.
3.3.2. Определить среднее значение gср, среднюю абсолютную ошибку Dgср.
| № опыта | h1, мм | h2, мм | 
| 
|
| Средние значения |
Лабораторная работа 8-05
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ ТВЕРДОГО ТЕЛА
И ПРИРАЩЕНИЯ ЭНТРОПИИ В ПРОЦЕССЕ ПЛАВЛЕНИЯ. ЗАКОН ДЮЛОНГА И ПТИ
1. Цель работы: ознакомление с особенностями процесса плавления, определение изменения энтропии в процессе плавления с помощью II начала термодинамики, экспериментальная проверка закона Дюлонга и Пти.
2. Теоретические основы. Макроскопическая система, т.е. система, состоящая из большого числа частиц, описывается с помощью термодинамических параметров: давление, объем, температура, плотность и т.д. Если параметры в разных частях системы одинаковы, состояние системы называется равновесным. Термодинамическим процессом называется изменение параметров состояния системы при обмене системы энергией в форме работы или теплоты с другой системой или с внешней средой. Равновесным называется процесс, при котором система проходит непрерывный ряд равновесных состояний. Чтобы это осуществить, процесс нужно проводить бесконечно медленно, так чтобы параметры различных частей системы успевали выровняться и принять одно и то же значение. Обратимым называется процесс, при котором система может возвратиться в исходное состояние через тот же ряд промежуточных состояний, как и в прямом процессе, но проведенных в обратной последовательности. При этом в окружающей среде не остается никаких изменений. Необходимым условием обратимости термодинамических процессов является их равновесность. Все реальные процессы протекают с конечной скоростью. Однако в некоторых случаях условия протекания процессов таковы, что их приближенно можно считать обратимыми. О направлении протекания процессов позволяет судить второе начало термодинамики, которое можно сформулировать с помощью понятия энтропии. Энтропия – количественная характеристика теплового состояния системы, описывающая ее стремление переходить из одного состояния в другое. Изменение энтропии не зависит от вида процесса, а определяется лишь параметрами начального и конечного состояния системы, т.е. энтропия является функцией состояния системы. Изменение энтропии в элементарном обратимом процессе dS = dQ/T, (1)
где dQ – бесконечно малое количество тепла, сообщенное системе, Т – температура системы. Изменение энтропии в обратимом процессе теплообмена  . (2)
. (2)
Если процесс необратимый, то dS > dQ/T, (3)
если система теплоизолирована, то  и
и  . (4)
. (4)
Это соотношение, устанавливающее направление теплообмена, можно сформулировать как второе начало термодинамики: в изолированных системах энтропия либо остается постоянной, либо возрастает при необратимых процессах.
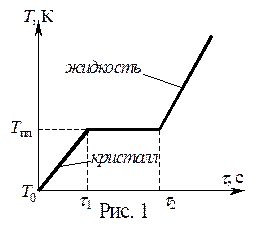 Если система обменивается теплом с окружающей средой, то по знаку изменения энтропии судят о направлении теплообмена. Из формулы (1) видно, что dS и dQ имеют одинаковый знак, поэтому при нагревании энтропия системы возрастает (
Если система обменивается теплом с окружающей средой, то по знаку изменения энтропии судят о направлении теплообмена. Из формулы (1) видно, что dS и dQ имеют одинаковый знак, поэтому при нагревании энтропия системы возрастает (  ), а при охлаждении – убывает (
), а при охлаждении – убывает (  ). При нагревании твердого тела, его температура будет увеличиваться от комнатной T0 до температуры плавления
). При нагревании твердого тела, его температура будет увеличиваться от комнатной T0 до температуры плавления  , затем вещество будет плавиться, т.е. переходить из твердого состояния в жидкое (при этом температура его не изменяется). Далее нагреваться будет жидкость. График зависимости температуры нагреваемого тела от времени τ будет состоять из трех участков: двух наклонных линейных участков и одного горизонтального (рис.1). Горизонтальный участок («плато») соответствует процессу плавления тела. При этом энергия нагрева расходуется на разрушение кристаллической решетки. Поэтому до полного разрушения всей решетки и перехода в жидкое состояние температура образца не меняется, несмотря на подводимую энергию. Чтобы нагреть тело массой m от температуры
, затем вещество будет плавиться, т.е. переходить из твердого состояния в жидкое (при этом температура его не изменяется). Далее нагреваться будет жидкость. График зависимости температуры нагреваемого тела от времени τ будет состоять из трех участков: двух наклонных линейных участков и одного горизонтального (рис.1). Горизонтальный участок («плато») соответствует процессу плавления тела. При этом энергия нагрева расходуется на разрушение кристаллической решетки. Поэтому до полного разрушения всей решетки и перехода в жидкое состояние температура образца не меняется, несмотря на подводимую энергию. Чтобы нагреть тело массой m от температуры  до температуры
до температуры  необходимо сообщить ему количество теплоты
необходимо сообщить ему количество теплоты  (5)
(5)
где c – удельная теплоемкость вещества (количество теплоты, необходимое для нагревания одного килограмма вещества на один Кельвин (Дж/(кг×К)). В данной работе используется малый объем плавящегося вещества, поэтому в процессе нагревания по всему объему успевает установиться равновесное состояние. Поэтому процесс можно считать обратимым и воспользоваться формулой (2). Приращение энтропии при нагревании от комнатной температуры до температуры плавления с учетом (5) равно
 (6)
(6)
Чтобы расплавить тело массой m, нагретое до температуры плавления, необходимо сообщить ему количество теплоты
 (7)
(7)
где λ – удельная теплота плавления (количество теплоты, которое необходимо чтобы расплавить один килограмм вещества, нагретого до температуры плавления Дж/кг). Приращение энтропия в процессе плавления с учетом (2), (7) равно
 (8)
(8)
Суммарное изменение энтропии в процессе нагревания и плавления  (9)
(9)
Теплоемкость моля химически простых (одноатомных) тел в кристаллическом состоянии одинакова и равна 3R (закон Дюлонга и Пти). Следовательно, чтобы нагреть некоторое количество вещества необходимо количество теплоты
 (10)
(10)
где М – молярная масса вещества,  и
и  соответственно начальная и конечная температура тела. Сравнивая (5) и (10) для химически простых тел получим с = 3R/М. (11)
соответственно начальная и конечная температура тела. Сравнивая (5) и (10) для химически простых тел получим с = 3R/М. (11)
3. Экспериментальная часть
3.1. Краткое описание экспериментальной установки.
 На рис. 2 приведена схема установки. В качестве нагреваемого тела используется олово массой т = 200 г. Мощность нагревателя Р = 150 Вт. Значения КПД нагревателя, определяющего долю теплоты, сообщаемой нагреваемому телу,смотрите ниже под расчетными формулами (12) и (13). Температура измеряется при помощи специального датчика температуры (термопары) и отображается на цифровом индикаторе в ºС.
На рис. 2 приведена схема установки. В качестве нагреваемого тела используется олово массой т = 200 г. Мощность нагревателя Р = 150 Вт. Значения КПД нагревателя, определяющего долю теплоты, сообщаемой нагреваемому телу,смотрите ниже под расчетными формулами (12) и (13). Температура измеряется при помощи специального датчика температуры (термопары) и отображается на цифровом индикаторе в ºС.
3.2. Методика проведения эксперимента
1. Подайте на установку питание, включив кнопку«СЕТЬ». При этом включится индикатор температуры. Запишите или запомните значение комнатной температуры Т0, которое он показывает в данный момент.
|
Таблица 1. Экспериментальные данные
| τ, с | t,ºC | T,K | τ, с | t,ºC | T,K | τ, с | t,ºC | T,K | τ, с | t,ºC | T,K | τ, с | t,ºC | T,K |
3.3. Обработка результатов измерений.
|
| ||||||||||||||||||||||||
0 30 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 τ, с
3.3.1. Переведите все значения температуры из Таблицы 1 в Кельвины T [K] = 273 + t[˚C]. По данным Таблицы 1 постройте график зависимости абсолютной температуры от времени  и выделите горизонтальный участок, где температура не меняется. Этот участок соответствует процессу плавления при температуре
и выделите горизонтальный участок, где температура не меняется. Этот участок соответствует процессу плавления при температуре  . Определите по графику температуру плавления.
. Определите по графику температуру плавления.
3.3.2. По графику определите экспериментальное значение удельной теплоемкости, выразив ее из формулы (5)
 (12)
(12)
где Р = 150 Вт – мощность нагревателя, h1 = 0,2 – КПД нагревателя, определяющий долю общей теплоты, передаваемую нагреваемому телу в процессе нагрева, m = 200г– масса олова,  – начальное значение абсолютной температуры,
– начальное значение абсолютной температуры,  – время нагрева до температуры плавления (в секундах). По формуле (11) вычислить теоретическое значение удельной теплоемкости (молярная масса олова 0.119 кг/моль).
– время нагрева до температуры плавления (в секундах). По формуле (11) вычислить теоретическое значение удельной теплоемкости (молярная масса олова 0.119 кг/моль).
3.3.3. По графику определите экспериментальное значение удельной теплоты плавления, выразив ее из формулы (7)
 (13)
(13)
где  – время плавления образца (длина горизонтального участка графика в секундах), h2 = 0,6 – КПД нагревателя, определяющий долю общей теплоты, передаваемую нагреваемому телу в процессе плавления.
– время плавления образца (длина горизонтального участка графика в секундах), h2 = 0,6 – КПД нагревателя, определяющий долю общей теплоты, передаваемую нагреваемому телу в процессе плавления.
3.3.4. По формулам (6), (8), (9) и вычисленным 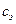 и
и  рассчитайте изменения энтропии в процессе нагрева, плавления и суммарное изменение энтропии. Результаты всех вычислений занесите в Таблицу 2.
рассчитайте изменения энтропии в процессе нагрева, плавления и суммарное изменение энтропии. Результаты всех вычислений занесите в Таблицу 2.
Таблица 2. Результаты вычислений
 , К , К
|  , Дж/(кг*К) , Дж/(кг*К)
|  , Дж/(кг*К) , Дж/(кг*К)
| λ, Дж/кг |  , Дж/К , Дж/К
|  , Дж/К , Дж/К
|  , Дж/К , Дж/К
|
Лабораторная работа 7-02
|
Просмотров 1712 |
|
|
