
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

ЭЛЕКТРОННЫЕ ПРЕДСТАВЛЕНИЯ О ПРИРОДЕ ХИМИЧЕСКОЙ СВЯЗИ
|
|
Положение о зависимости свойств от химического строения.
Свойства органических веществ зависят не только от количества и природы атомов, входящих в его молекулу, но и от того, в каком порядке они соединяются. Это положение позволило дать объяснение явлению изомерии, когда вещества, имеющие одинаковые эмпирические формулы, но различное химическое строение отличаются по свойствам.
Были выявлены разновидности структурной изомерии:
а) изомерия углеродной цепи
СН3-СН2-СН2-СН3
бутан

изобутан
б) изомерия положения (кратных связей или заместителей)
| СН2=СН-СН2-СН3 | a-бутилен | СН3-СН2-СН2-ОН | бутиловый спирт |
| СН3-СН=СН-СН3 | b-бутилен | 
| изобутиловый спирт |
в) метамерия (неуглеродные многовалентные атомы соединены с различными радикалами):
СН3-О-СН2-СН2-СН3 метилпропиловый эфир
СН3-СН2-О-СН2-СН3 диэтиловый эфир
г) таутомерия – динамическое равновесие двух изомерных форм, способных переходить друг в друга за счет внутримолекулярных перегруппировок:
| Ацетоуксусный эфир | ||

|

| 
|
| (кетонная форма) | (енольная форма) |
Положение о взаимном влиянии атомов.
Атомы, связанные в одну молекулу, взаимно влияют друг на друга. Молекулярной формуле С2Н6О соответствуют два метамера:

| 
|
| этиловый спирт | диметиловый эфир |
Один из атомов водорода в спирте может замещаться на натрий, в то время как эфир с металлическим натрием не взаимодействует. Причина – в спирте один атом водорода связан с кислородом.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Развитие теории химического строения позволило Бутлерову провести четкую классификацию органических соединений.
По строению углеродного скелета все органические вещества делятся на три основных вида:
I. Соединения с открытой цепью углеродных атомов (жирные, алифатические, ациклические).
II. Соединения с замкнутой цепью углеродных атомов (карбоциклические, изоциклические).
III. Соединения с замкнутой цепью, состоящей не только из атомов углерода, но и других элементов (гетероатомов), например: N, O, S (гетероциклические соединения).
Внутри каждого раздела проводится более детальная классификация по признаку состава и наличия функциональных групп.
| Состоят из атомов | Функциональная группа | ||
| 1. | Углеводороды | С, Н | - |
| 2. | Галогенопроизводные | С, Н, Гал | Гал |
| 3. | Кислородсодержащие соединения | С, Н, О | |
| а) спирты | -ОН | ||
| б) альдегиды и кетоны | >С=О | ||
| в) карбоновые кислоты |   О О
 ____С
ОН ____С
ОН
| ||
| 4. | Серосодержащие соединения | С, Н, S (О) | |
| а) тиоспирты | -SH | ||
| б) тиоэфиры | -S- | ||
| в) сульфокислоты | 
| ||
| 5. | Азотсодержащие соединения | С, Н, N (О) | |
| а) нитросоединения | -NО2 | ||
| б) амины | -NH2 | ||
| 6. | Элементорганические соединения | С, Н, Э | |
| а) металлорганические | С, Н, Ме | ||
| б) кремнийорганические | С, Н, Si (O) | ||
| в) фосфорорганические и т.д. | С, Н, Р (О) | и др. |
ЭЛЕКТРОННЫЕ ПРЕДСТАВЛЕНИЯ О ПРИРОДЕ ХИМИЧЕСКОЙ СВЯЗИ
В органических соединениях преобладающим типом связи является ковалентная связь, образующаяся чаще всего между атомами, имеющими неспаренные электроны. Количество неспаренных электронов у атома можно определить, используя понятия квантовой химии. Электрон обладает двойственной природой: он может проявлять свойства частицы и свойства волны. При движении вокруг ядра атома каждый электрон создает электронное облако, определенным образом распределенное в пространстве. Пространство, занимаемое электронным облаком, называется атомной орбиталью. Каждое устойчивое положение электрона определяется четырьмя квантовыми числами:
1. Главное квантовое число n- показывает уровень энергии электронов, который определяется расстоянием электрона от ядра;
2. Побочное (орбитальное) квантовое число l характеризуется моментом количества движения электрона относительно ядра и определяет форму атомной орбитали. В зависимости от числа l, принимающего значения до n-1, то есть 0,1,2,3, различают s, p, d, f-подуровни. Для s-подуровня (L=0) электронное облако имеет сферическую форму, для р-подуровня (L=1) – форму гантелей, d и f-орбитали (L=2, 3) имеют похожую, но более сложную форму.
3. Магнитное квантовое число ml характеризует ориентацию орбитали по отношению к внешнему магнитному полю.S-орбиталь имеет центр симметрии и может иметь только одну ориентацию.
Р-орбиталь имеет ось симметрии, может располагаться в трех взаимно перпендикулярных плоскостях.

| 
|
| s-орбиталь | p-орбиталь |
Рисунок 1
4. Спиновое квантовое число ms характеризуется моментом количества вращения электрона вокруг собственной оси. Так как электрон может вращаться только в двух направлениях – по и против часовой стрелки, спин имеет два значения. В одной орбитали могут размещаться два электрона с противоположными спинами.
Если атомная орбиталь содержит один (неспаренный) электрон, такое состояние неустойчиво, так как у атома имеется нескомпенсированный магнитный (спиновый) момент и он стремится обобщить свой неспаренный электрон с неспаренным электроном другого атома.
Количество неспаренных электронов может увеличиваться в результате возбуждения атома. Возбуждение возможно при получении кванта энергии и при наличии незаполненной орбитали на внешнем энергетическом подуровне, при этом один из спаренных электронов переходит на ближайший подуровень, например, с s-подуровня на р-подуровень или с р-подуровня на d-подуровень. Углерод имеет 6 электронов со следующим их распределением по энергетичесским уровням и подуровням:

|

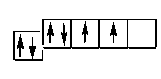
|
Просмотров 1710 |
|
|
