
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

III тип. Реакции термического расщепления предельных углеводородов
|
|
1.Крекинг – расщепление предельных углеводородов на более низкомолекулярные предельные и непредельные углеводороды. Протекает при нагревании без доступа воздуха до 450-550оС. Механизм термического крекинга – свободно-радикальный.

 2 1 1 СН3-СН2-СН2 . . СН3
2 1 1 СН3-СН2-СН2 . . СН3  СН3-СН=СН2+СН4
СН3-СН=СН2+СН4
 СН3-СН2 : СН2 : СН3
СН3-СН2 : СН2 : СН3
 бутан 2 СН3-СН2 . + . СН2-СН3
бутан 2 СН3-СН2 . + . СН2-СН3  СН2=СН2+СН3-СН3
СН2=СН2+СН3-СН3
При расщеплении более высокомолекулярных углеводородов при невысоком давлении могут протекать реакции  -распада образовавшихся свободных радикалов.
-распада образовавшихся свободных радикалов.
С10Н22  2СН3-СН2-СН2 : СН2-СН2
2СН3-СН2-СН2 : СН2-СН2  2СН3-СН2-СН2 . + 2СН2=СН2
2СН3-СН2-СН2 . + 2СН2=СН2
Декан 2С10Н22
2С10Н21 . + 2СН3-СН2-СН3
2.Дегидрирование (дегидрогенизация) – отщепление водорода происходит под действием более высокой температуры, чем крекинг.

 СН3-СН=СН-СН3 2-бутен
СН3-СН=СН-СН3 2-бутен
СН3-СН2-СН2-СН3 
бутан -Н2
 СН3-СН2-СН=СН2 1-бутен
СН3-СН2-СН=СН2 1-бутен
В присутствии катализаторов, например, Сr2O3, температура реакции может быть снижена до 300оС.
IV тип. Изомеризация предельных углеводородов
СН3-СН2-СН2-СН2-СН3  СН3-СН-СН2-СН3
СН3-СН-СН2-СН3
Пентан Н2SO4 CН3
изопентан
ЛЕКЦИЯ 3
Алкены
Это углеводороды открытого строения с одной двойной связью. Общая молекулярны формула СnН2n (содержит на два атома водорода меньше по сравнению с парафинами).
| Гомологический ряд | Тривиальное название | |
| С2Н4 | СН2=СН2 | Этилен |
| С3Н6 | СН2=СН-СН3 | Пропилен |
| С4Н8 | СН2=СН-СН2-СН3 |  -бутилен -бутилен
|
| СН3-СН=СН-СН3 |  -бутилен -бутилен
| |
| СН2=С-СН3 СН3 | Изобутилен |
Тривиальное название отличается от названия соответствующих предельных углеводородов окончанием "илен".
Углеводород С4Н8 имеет и структурные, и пространственные изомеры.
Структурная изомерия представлена изомерией цепи
СН2=СН-СН2-СН3 и СН2=С-СН3
СН3
и изомерией положения двойной связи
СН2=СН-СН2-СН3 и СН3-СН=СН-СН3.
Пространственная изомерия наблюдается тогда, когда оба ненасыщенных атома углерода имеют хотя бы по одному заместителю. Например, СН3-СН=СН-СН3, так как относительно двойной связи нет свободного вращения, положение групп, связанных с ненасыщенным атомом углерода, является фиксированным в пространстве, при этом может быть два различных соединения, а именно:
H H CH3 H
C=C C=C
CH3 CH3 H CH3
цис-изомер транс-изомер
Этот вид изомерии называется геометрической или цис-транс-измоерией. Цис-изомеры более полярны и имеют более высокие температуры кипения.
Номенклатура
Рациональная номенклатура рассматривает этиленовые углеводороды как производные простейшего члена ряда – этилена.
| Рациональная | IUPAC | |
| СН3-СН=СН2 | метилэтилен | пропен |
| СН3-СН-СН=СН2 | этилэтилен | 1-бутен |
| СН3-СН=СН-СН3 | Sim диметилэтилен | 2-бутен |
| СН3-С=СН2 СН3 | Asim диметилэтилен | 2-метил-1-пропен |
Систематическая номенклатура. За основу беертся самая длинная углеродная цепь, в состав которой входит двойная связь. Эта цепь нумеруется с того конца, к которому ближе расположена двойная связь; радикалы, не вошедшие в основную цепь, перечисляются вначале названия. Положение их указывается цифрами, затем идет название основы, которая строится аналогично названию предельного углеводорода с заменой суффикса "ан" на "ен". Положение двойной связи указывается меньшей цифрой перед названием основы.
Способы получения
1.Дегидрогенизация и крекинг предельных углеводородов (промышленные методы получения) см. свойства парафинов.
2.Отщепление галогеноводорода от моногалогенопроизводных предельных углеводородов.
H H
H-C-C-H  HCl + CH2=CH2
HCl + CH2=CH2
H Cl
хлористый этил
Реакция идет при более мягких условиях, если действовать спиртовым раствором целочи
H H
CH3-C-C-CH3 + KOH  CH3-CH=CH-CH3
CH3-CH=CH-CH3
Cl H (спирт) -H2O  -бутилен
-бутилен
хлористый вторбутил
Реакция протекает согласно правила Зайцева: водород отщепляется от наменее гидрированного из двух соседних с галогеносодержащим атомов углерода, т.к. термодинамически более устойчивы олефины, у которых непредельные атомы углерода связаны с алкилами, а не с водородом.
H H
H-C-CH=CH-C-H 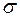 -
-  -сопряжение с участием 12
-сопряжение с участием 12 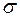 -электронов
-электронов
H H С-Н связей
3.Дегидратация спиртов протекает в присутствии сильных минеральных кислот (Н2S04, H3PO4).
OH
СH3-CH-CH2-CH3  CH3-CH=CH-CH3 + H2O
CH3-CH=CH-CH3 + H2O
вторичный бутиловый спирт  -бутилен
-бутилен
4.Отщепление 2-х атомов галогена от вицинальных дигалогенопроизводных углеводородов.
СH2-CH2 + Zn  ZnBr2 + CH2=CH2
ZnBr2 + CH2=CH2
Br Br
5. Частичное гидрирование ацетиленовых углеводородов
CH  CH + H2
CH + H2  CH2=CH2
CH2=CH2
|
Просмотров 1258 |
|
|
