
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Спирты одноатомные, их строение, номенклатура, методы получения
|
|
Спирты одноатомные-эти органические вещества, молекулы которых содержат функциональную гидроксильную группу-ОН, ,соединенную с углеводородным радикалом.. Или –это производные углеводородов, в молекулах которых атом водорода замещен на гидроксильную группу.
Спирты классифицируются: 1) по строению углеводородного радикала различают: а) спирты алифатического (жирного ряда), Аlk-ОН; б) ароматические, которые разделяются на фенолы Аr-OH и жирноароматические спирты Ar(CH2)n-OH; 2) по числу гидроксиловспирты бывают одно-, двух– и многоатомные. Например: а) одноатомные спирты СН3-ОН (метанол); б) двухатомный спирт HO-CH2-CH2OH (этандиол); в) трехатомный спирт НОСН2-СНОН-СН2ОН (глицерин).
В зависимости от характера углеродного атома, при котором находится гидроксил, различают первичные, вторичные и третичные спирты.
1) R-CH2-OH, или Аr-СН2-ОН, – первичный спирт;
2)
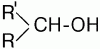
– вторичный спирт;
3)

– третичный спирт.
Изомерия и номенклатура.
Изомерия спиртов зависит от строения углеводородной цепи и положения гидроксила в цепи. Спирты часто называют по радикально-спиртовой и систематической (ИЮПАК) номенклатуре.
При названии спирта по радикально-спиртовой номенклатуре в основе лежит название соответствующего углеводородного радикала, связанного с гидроксилом, с прибавлением окончания – овый спирт. Например: 1) СН3-ОН – метиловый спирт (древесный); 2) С2Н5-ОН – этиловый спирт; 3) н-С4Н9ОН – бутиловый спирт;
4)

– трет-бутиловый спирт.
В основе названия спирта по ИЮПАК лежит наименование углеводорода самой длинной углеводородной цепи, наличие же гидроксильной группы указывается окончанием – ол, с цифрой за ним, указывающей номер атома углерода, при котором стоит гидроксил. При этом углеродная цепь нумеруются таким образом, чтобы гидроксил имел наименьший номер:
1)

– пентанол-2;
2)
 – 3,4,4-триметилгексанол-2.
– 3,4,4-триметилгексанол-2.
Способы получения спиртов:
1. Щелочных гидролиз галогенов;
2. .Гидратация алкенов;
3. 3Восстановление кислородосодержащих содинений
4. 4.Брожение глюкозы- только для этанола;
5. Из синтеза-газа- только для метанола.
15. Спирты многоатомные.,органические соединения, содержащие гидроксильную группу OH у насыщенного атома углерода. Различают спирты одноатомные (например, метиловый и этиловый спирты), двухатомные (гликоли), трехатомные (глицерины) и многоатомные.
Многоатомные спирты(м.с.) —органические соединения содержащие в своём составе более одной гидроксильной группы ОН
М. с. — бесцветные кристаллические вещества сладкого вкуса, легко растворимые в воде; многие из них синтезируются растениями; для каждого спирта известно большое число стереоизомеров. М. с. обладают всеми свойствами одноатомных спиртов (они легко, например, этерифицируются и окисляются). Нитраты М. с. обладают взрывчатыми свойствами. М. с. в промышленности получают обычно восстановлением соответствующих альдоз и кетоз; применяют в производстве полимеров, взрывчатых веществ, используют в качестве заменителей сахара для больных диабетом (сорбит, ксилит), в косметической и фармацевтической промышленности
Химические свойства многоатомных спиртов:
1. Как вещества, которые содержат гидроксильные группы, многоатомные спирты имеют сходные свойства с одноатомными спиртами.
2. При действии галогеноводородных кислот на спирты происходит замещение гидроксильной группы:
СН2ОН-СН2ОН + Н СI → СН2ОН-СН2СI + Н2О.
3. Многие спирты обладают и особыми свойствами: многоатомные спирты проявляют более кислые свойства, чем одноатомные и легко образуют алкоголяты не только с металлами, но и с гидроксидами тяжелых металлов. В отличие от одноатомных спиртов, многоатомные спирты реагируют с гидроксидом меди, давая комплексы синего цвета (качественная реакция на многоатомные спирты).

Способы получения и применения многоатомных спиртов
1) многоатомные спирты могут быть получены из углеводородов через их галогенопроизводные; 2) наиболее употребительный многоатомный спирт – глицерин, он получается расщеплением жиров, а в настоящее время все больше синтетическим способом из пропилена, который образуется при крекинге нефтепродуктов.
16. Карбоновые кислоты, Классификация, номенклатура.Карбоновые кислоты являются производными углеводородов, в которых один или несколько атомов водорода замещены на карбоксильную группу.
Карбоновые кислоты можно подразделить на две основные группы:
Монокарбоновые кислоты (насыщенные, ненасыщенные, аренкарбоновые кислоты).
Ди- и поликарбоновые кислоты (ненасыщенные, насыщенные, арендикарбоновые и поликарбоновые кислоты).
Монокарбоновые кислоты
Классификация , изомерия и номенклатура
Монокарбоновые кислоты подразделяют в зависимости от природы углеводородного остатка.
a) Насыщенные монокарбоновые кислоты (производные алканов и циклоалканов): CnH2n+1COOH ,
б) Ненасыщенные монокарбоновые кислоты (производные алкинов, алкенов, алкадиенов и других ненасыщенных углеводородов, CnH2n-1COOH , CnH2n-3COOH и др.
в) Аренмонокарбоновые кислоты ArCOOH, ArCH2COOH, ArCH=CHCOOH
Согласно номенклатуре IUPAC название карбоновых кислот образуют от названия родоначальных углеводородов с тем же числом атомов углерода, включая и атом карбоксильной группы, и окончания “–овая кислота”.
Нумерацию начинают от атома углерода карбоксильной группы. Многие карбоновые кислоты сохраняют тривиальные названия. Иногда название карбоновой кислоты образуют от названия углеводорода, содержащего карбоксильную
18.. Предельные углеводороды (алканы), строение, номенклатура и хим. свойства.Предельные углеводороды, или алканы. (международное название), – это соединения, состав которых выражается общей формулой СnН2n+2, где n – число атомов углерода.
Особенности предельных углеводородов (алканов):
1) в молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью;
2) остальные валентности насыщены атомами водорода;
3) алканы также называются насыщенными углеводородами,или парафинами;
4) первым членом гомологического ряда алканов является метан (С Н4);
5) начиная с пятого углеводорода название образуется от греческого числительного, которое указывает число углеродных атомов в молекуле;
6) в гомологическом ряду наблюдается изменение физических свойств углеводородов: а) повышаются температуры кипения и плавления; б) возрастает плотность;
7) алканы начиная с четвертого члена ряда (бутана) имеют изомеры.
Номенклатура алканов и их производных.
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, которые называются углеводородными радикалами. Радикалы образуются не только органическими, но и неорганическими соединениями.
Если отнять от молекулы углеводорода два атома водорода, получаются двухвалентные радикалы.
Для названия изомеров применяются две номенклатуры:
1) рациональная – старая; 2) заместительная (систематическая или международная) – современная. Предложена Международным союзом теоретической и прикладной химии ИЮПАК.Особенности рациональной номенклатуры:
1) по рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы; 2) рациональная номенклатура удобна для не очень сложных соединений.
Особенности заместительной номенклатуры:
1) по заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители; 2) если в формуле содержится несколько одинаковых радикалов, то перед их названием указывается число прописью, а номера радикалов разделяются запятыми.
СН4 – метан; С2Н 6 – этан;С3Н8 -пропан;С4Н10 -бутан;С5Н12-пентан;С6Н 14-гексан;С7Н16 –гептан;С8Н 18-октан
С9Н20-нонан;С10 Н22-декан
19.
|
Просмотров 2705 |
|
|
