
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Уравнение Ван-дер-Ваальса (ВдВ)
|
|
В научной литературе существуют более 150 отличающихся друг от друга уравнений состояния реального газа. Среди них нет ни одного действительно верного и универсального.
Остановимся на уравнении ВдВ (1873 г). Он внес в уравнение Клапейрона-Менделеева PV=RT две поправки.
Первая поправка связана с действием сил отталкивания между молекулами. Она учитывает собственный объем молекулы V0 и поэтому объем сосуда V заменяют свободным объемом V-b, где b=4V0NA. В итоге получаем уравнение Клаузиуса для одного моля
P=RT/(V-b). (1)
Вторая поправка связана с действием сил притяжения между молекулами: в тонком поверхностном слое вблизи стенки сосуда на молекулу, подлетающую к стенке, действует сила притяжения со стороны остальных молекул газа, что приводит к уменьшению силы удара молекулы о стенку сосуда, а, следовательно, и давления на величину DP~  , в результате имеем P=RT/(V-b) – a/
, в результате имеем P=RT/(V-b) – a/ 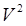 или
или
(P+ a/ 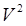 )(V-b)=RT, (2)
)(V-b)=RT, (2)
которое называют уравнением ВдВ для одного моля газа. В этом уравнении а и b – постоянные, зависящие только от вида газа.
Для произвольной массы газа уравнение ВдВ имеет вид
(P+  a/
a/ 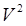 )(V-nb)= nRT, (3)
)(V-nb)= nRT, (3)
где n=m/M – число молей газа, m – масса газа, M – масса моля.
Изотермы Ван-дер-Ваальса
Для фиксированных значений Р и Т уравнение (2) есть уравнение третьей степени относительно объема газа V и, следовательно, оно может иметь либо три вещественных корня (V1, V2, V3), либо один вещественных корень (V1) и два комплексно-сопряженных корня (комплексно-сопряженные корни отбрасываем). Поэтому на диаграмме PV (см.рис.2) прямая, параллельная оси V может пересекать изотерму ВдВ либо в трех точках В, D, F, либо в одной K или L. Построение по точкам изотерм ВдВ для трех характерных температур приводит к кривым, изображенным на рис.2. Сначала проведем анализ нижней изотермы ABCDEFG.
 Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Ветви ВС и EF изображают метастабильные состояния вещества (т.е. относительно устойчивые состояния): перегретую жидкость и пересыщенный пар и могут быть осуществлены при определенных условиях. Участок СДЕ ни при каких условиях осуществлен быть не может.
 С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
При Т>ТКР газ никаким сжатием нельзя перевести в жидкость.
Возвращаясь к анализу изотерм ВдВ, изображенных на рис.2, делаем заключение, что область, ограниченная сверху изотермой НК и справа линией КВМсоответствует жидкой фазе. Область, ограниченная сверху кривой МВКFN, соответствует жидкой и газообразной фазе (жидкость + пар) и область, расположенная правее линии НКFN, соответствует газообразной фазе.
При Т>>ТКР и относительно малых давлениях реальные газы ведут себя как идеальные газы.
Внутренняя энергия моля реального газа
U=CVТ –a/V, (4)
т.е. меньше энергии идеального газа U=CVТ. Для произвольной массы реального газа
U=n(CVТ –a/V). (5)
Фазы и фазовые переходы
Фазой называется совокупность частей системы одинаковых по всем физическим, химическим свойствам и структурному составу. Например, существует твердая, жидкая и газообразная фазы (называемые агрегатными состояниями).
Фазовый переход (фазовое превращение), в широком смысле – переход вещества из одной фазы в другую при изменении внешних условий (Т, Р, магнитных и электрических полей и т.д.); в узком смысле – скачкообразное изменение физических свойств при непрерывном изменении внешних параметров. Будем далее рассматривать фазовые переходы в узком смысле.
Различают фазовые переходы I рода и II рода. Фазовый переход I рода – широко распространенное в природе явление. К ним относятся: испарение и конденсация, плавление и затвердевание, сублимация или возгонка (переход вещества из кристаллического состояния непосредственно, без плавления, в газообразное, например, сухой лед) и конденсация в твердую фазу и др. Фазовые переходы I рода сопровождаются выделением или поглощением теплоты (теплоты фазового перехода q), при этом скачком изменяются плотность, концентрация компонентов, молярный объем и т.д.
Фазовый переход II рода не сопровождается выделением или поглощением теплоты, плотность изменяется непрерывно, а скачком изменяется, например, молярная теплоемкость, удельная электрическая проводимость, вязкость и др. Примерами фазовых переходов II рода могут служить переход магнитного вещества из ферромагнитного состояния (m>>1) в парамагнитное (m»1) при нагреве до определенной температуры, называемой точкой Кюри; переход некоторых металлов и сплавов при низких температурах из нормального состояния в сверхпроводящее и др.
|
Просмотров 1067 |
|
|
