
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях
|
|
Окислительно-восстановительные процессы связаны с перераспределением электронов между атомами или ионами веществ, участвующих в реакции. Принято считать процесс отдачи веществом электронов окислением, а процесс присоединения электронов – восстановлением. Если одно вещество теряет электроны, то другое вещество, участвующее в реакции, должно их присоединить, при этом общее число электронов, отдаваемых восстановителем, должно быть равно общему числу электронов, присоединяемых окислителем.
Процесс окисления-воостановления с участием кислородсодержащих ионов является сложным процессом, поскольку одновременно с переходом электронов от восстановителя к окислителю происходит разрыв ковалентных связей. Такие реакции протекают с участием молекул или ионов среды. Существует несколько методов составления окислительно-восстановительных реакций, наиболее совершенным среди которых является ионно-электронный метод. Сущность этого метода заключается в следующем:
1. Вначале составляют частные уравнения процесса окисления и процесса восстановления, записывая вещества в той форме, в которой они существуют в растворе: сильные электролиты в ионной форме, слабые – в молекулярной.
2. С участием ионов среды (Н+ в кислой, ОН- в щелочной) или молекул H2O осуществляют материальный баланс, а затем электронный баланс.
3. Составленные частные уравнения суммируют, умножая на соответствующие коэффициенты, подобранные таким образом, чтобы число электронов, теряемых восстановителем, было бы равно числу электронов, приобретаемых окислителем. В результате получают ионное уравнение окислительно-восстановительной реакции.
4. Переносят соответствующие коэффициенты из ионного уравнения в уравнение реакции, написанное в молекулярной форме, и уравнивают количество ионов, не принимавших участие в процессе окисления и восстановления.
Пример:


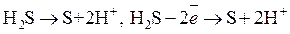



42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
В электрохимии электродом называется проводник первого рода, погруженный в раствор электролита в условиях прохождения через него тока.
В объеме металла имеем подвижное равновесие: 
На электроде имеем: 
Поверхность электрода заряжается отрицательно за счет оставшихся на нем электроном, вследствие чего перешедшие в раствор гидратированные катионы не могут отойди от электрода и остаются вблизи него, образуя в совокупности с электронами т.н. двойной электрический слой. Пограничный слой жидкости заряжается положительно, металл – отрицательно, получается конденсатор. Возникает скачок электрических потенциалов – электродный потенциал.
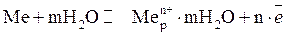
Толщина двойного слоя зависит от концентрации, температуры, заряда металла, колеблясь от нескольких ангстрем до микрона. Переход ионов металла в раствор – окисления, обратный процесс превращения гидратированных ионов металла в атомы – восстановление. Потенциал, отвечающий состоянию равновесию, когда скорость восстановления равна скорости окисления, называют равновесным потенциалом.
При погружении любого металла в воду имеем качественно одно и то же – металл заряжается отрицательно, жидкость вокруг – положительно.
При помещении активного и неактивного металла в растворы их солей активный заряжается отрицательно, а неактивный – положительно.
|
Просмотров 998 |
|
|
