
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Принцип подвижного равновесия (принцип Ле-Шателье)
|
|
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.

1. Влияние концентраций (парциальных давлений). Увеличение С метана увеличивает С продуктов, уменьшает С водяного пара, равновесие смещается вправо. Введение диоксида углерода сместит равновесие влево.
2. Влияние общего давления в системе. Увеличение общего давления вызывает смещение расновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. В данной реакции – влево.
3. Влияние температуры. С увеличением температуры равновесие смещается в сторону эндотермических реакций. Повышение температуры в данной реакции (∆Н>0) смещает равновесие вправо, а для экзотермической реакции  (∆H<0) влево.
(∆H<0) влево.
Скорость химической реакции. Закон действующих масс. Константа скорости.
Количественно скорость реакции принято характеризовать изменением концентрации реагирующих веществ в единицу времени. Различают истинную и среднюю скорость.

Гомогенные реакции проходят сразу по всему объему, гетерогенные – на границе раздела фаз.
Закон действующих масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
 , где k-константа скорости реакции. Выполняется для идеальных газов или бесконечно разбавленных растворов.
, где k-константа скорости реакции. Выполняется для идеальных газов или бесконечно разбавленных растворов.
Константа скорости численно равна скорости, когда концентрации равны единице.
Молекулярность и порядок реакции.
С точки зрения числа частиц, участвующих в реакции, последние классифицируют по признаку молекулярности или порядка.
Молекулярность реакции определяется по числу молекул, одновременное соударение которых приводит к химическому взаимодействию. Различают одно-, двух- и трехмолекулярные реакции.
Одномолекулярная реакция:  ,
, 
Двухмолекулярная реакция: 
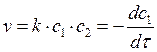
Трехмолекулярная реакция: 

Порядок реакции равен сумме показателей степеней у концентраций в уравнении, выражающем зависимость скорости реакций от концентраций реагирующих веществ.
Например реакция  формально является трехмолекулярной, но идет в две стадии
формально является трехмолекулярной, но идет в две стадии  , одна из которых медленная и по сути определяет скорость реакции.
, одна из которых медленная и по сути определяет скорость реакции.
Реакция  протекает в 2 стадии и является реакцией 2 порядка.
протекает в 2 стадии и является реакцией 2 порядка.
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
Согласно эмпирическому правилу Вант-Гоффа, повышение температуры на каждые  приводит к увеличению скорости реакции в 2-4 раза.
приводит к увеличению скорости реакции в 2-4 раза.
 - температурный коэффициент скорости реакции
- температурный коэффициент скорости реакции
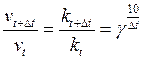
Увеличение скорости нельзя объяснить увеличением скорости молекул, т.к. при увеличении температуры на 100 градусов скорость молекул увеличивается на 20%, а скорость реакции десятки тысяч раз.
Уравнение Аррениуса:  или
или 
Допущения Аррениуса: 
Для реакции, протекающей при 

Для реакций, протекающих при одной Т, но с разными Еа и kT 
|
Просмотров 1206 |
|
|
