
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Физическая теория растворов (Вант-Гофф)
|
|
Растворитель является индифферентной средой, в которой равномерно размешаны молекулы растворенного вещества по всему объему раствора. Взаимодействия между чатицами и молекулами нет. Теория оправдывается для разбавленных растворов неэлектролитов.
Химическая теория растворов (Менделеев).
Растворитель дает с растворенным веществом определенные соединения – сольваты.
Молекулы сольватов образуют с растворителем молекулярную смесь.
Причина образования сольватов – проявление донорно-акцепторных и водородных связей. Вокруг ионов располагаются молекулы растворителя, образуя сольватные слои (оболочки).
Сольваты менее прочны, чем обычные химические соединения. Легко разрушаются даже при небольшом повышении температуры растворов.
Растворение сопровождается выделением/поглощением теплоты, сокращением/увеличением объема.
Теплота растворения вещества – количество теплоты, поглощаемой (выделяемой) при растворении одного моля вещества.
Растворимость твердых веществ в жидкостях.
Зависит от природы твердых тел, природы растворителя и температуры.
С повышением температуры, как правило, растворимость увеличивается (так как теплоты растворения имеют отрицательные значения).
Для идеальных растворов справедливо уравнение Шредера:  N1 – растворимость твердого вещества,
N1 – растворимость твердого вещества, 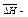 энтальпия растворения 1 моля вещества в насыщенном растворе.
энтальпия растворения 1 моля вещества в насыщенном растворе.
Растворение твердого вещества можно представить в две стадии: плавление вещества и смешение жидкого вещества с раствором. Тогда энтальпия смешения равна нулю, 
Идеальная растворимость увеличивается с повышением температуры (такие системы немногочисленны).
Давление мало влияет на растворимость твердых веществ.
При понижении температуры происходит выпадение вещества в осадок – процесс кристаллизации.
Растворимость жидкостей в жидкостях.
Растворимость увеличивается с повышением температуры и почти не зависит от давления.
Существуют неограниченная растворимость и растворимость до известного предела.
1. жидкости смешиваются в любых пропорциях (спирт и вода).
2. имеет место расслаивание (образование двух слоев – верхний и нижний). пример: эфир и вода.
Расслаивание уменьшается с ростом температуры и исчезает при некоторой (критической) температуре.
Законы Рауля.
Особенность растворов: давление пара растворителя над раствором ниже, чем над чистым растворителем.
Первый закон.
Давление пара растворителя над раствором пропорционально мольной доле растворителя в растворе.
Или
Относительно понижение давление пара растворителя над раствором равно мольной доли растворенного вещества.
Введем обозначения:
 давление пара растворителя над чистым растворителем;
давление пара растворителя над чистым растворителем;
 давление пара растворителя над раствором;
давление пара растворителя над раствором;
 абсолютное понижение давления;
абсолютное понижение давления;
 относительное понижение давления.
относительное понижение давления.

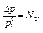
Если система полностью подчиняется закону, на графике наблюдаются прямолинейные зависимости. Однако в реальных системах наблюдаются отклонения.
Примечание автора. Обязательна графическая иллюстрация.

Температура замерзания раствора ниже температуры замерзания чистого растворителя, а температура кипения – выше.
Второй закон.
Повышение температуры кипения раствора и понижение температуры его замерзания пропорциональны моляльной концентрации раствора.

 К – константа, характеризующая растворитель.
К – константа, характеризующая растворитель.
 не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
С помощью законов Рауля можно определять неизвестные молекулярные массы растворенных веществ.
|
Просмотров 1811 |
|
|
