
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Гидролиз солей. Константа и степень гидролиза
|
|
Гидролиз - разложение солей под действием воды.
Вторая формулировка. Процесс, обратный нейтрализации, приводящий к образованию кислоты и основания.
Нейтрализация – реакция между кислотой и основанием.
1. Гидролиза нет
-если сильное основание и сильная кислота.
-если нерастворимые вещества («н» в таблице).
Пример. 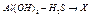
2. Полный гидролиз
-если слабая кислота и слабое основание.
-если «-» в таблице растворимости.
Пример. 
3. 
-если сильное основание и слабая кислота.
-если слабое основание и сильная кислота.
Пример. 
Константа гидролиза: 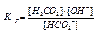
Степень гидролиза – применяется для характеристики реакций гидролиза.

Степень возрастает с ростом температуры и с уменьшением концентрации (разбавлением).
ОВР. Ионно-электронный метод подбора коэффициентов в ОВР.
Любая ОВР состоит из процессов окисления и восстановления.
Окисление –отдача электронов веществом, т.е повышение степени окисления элемента.
Пример. 
Вещества, отдающие электроны, называют восстановителями.
Типичные восстановители: водород, металлы, углерод.
Восстановление –смещение электронов к веществу или понижение степени окисления.
Пример. 
Вещества, принимающие электроны, называют окислителями.
Типичные окислители: галогены, водород, соединения кислорода 
Существуют реакции межмолекулярные (окислители и восстановители – разные вещества) и внутримолекулярные (окислители и восстановители – атомы одной молекулы).
Ионно-электронный метод подбора коэффициентов в ОВР.
1. Осуществить материальный баланс с помощью ионов 
2. Установить баланс с помощью зарядов.
3. Полученные 2 уравнения просуммировать так, чтобы число отданных электронов равнялось числу принятых.
4. Получается ионное уравнение ОВР. Перенести коэффициенты из ионного уравнения в молекулярное.
5. Уравнять ионы, не участвовавшие в схеме.
Пример.

______________________________________

43.Возникновение скачка потенциала на границе “металл-раствор”. Равновесный электродный потенциал.
Электрохимия –область физической химии, охватывающая химические процессы, сопровождающиеся возникновением электрического тока, либо вызванные действием электрического тока.
Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. В объеме металла устанавливается подвижное равновесие: Ме=Men++ n*ē. При погружении электрода в воду катионы металла гидратируются полярными молекулами воды и переходят в раствор, Men++ mH2O=Meрn+m*H2O.
Поверхность электрода заряжается отрицательно за счет оставшихся электронов, из-за этого перешедшие в раствор катионы не могут отойти от электрода. Катионы и электроны создают двойной электрический слой (его толщина зависит от концентрации раствора, температуры, заряда металла). Пограничный слой жидкости заряжается положительно, поверхность металла отрицательно, возникает скачок электрического потенциала – электродный потенциал.
Потенциал, отвечающий состоянию равновесия, когда скорость перехода ионов в раствор равна скорости их осаждения – равновесный потенциал.
Для всех металлов, погружаемых в чистую воду, качественно наблюдается одинаковая картина: металл заряжается отрицательно, прилегающий слой жидкости – положительно.
Данный скачок можно охарактеризовать реакцией: 
Рассмотрим погружение в раствор активного и неактивного металла.
1. Активный металл посылает большое число ионов в раствор, равновесная концентрация его ионов трудно достижима => металл будет заряжаться отрицательно.
2. Равновесная концентрация очень мала => электроду сообщается положительный заряд, а оставшиеся анионы создают отрицательный заряд у прилегающего слоя.

|
Просмотров 1117 |
|
|
