
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Метод термодинамічних потенціалів. Термодинамічний потенціал Гібса. Співвідношення Максвелла і рівняння Гібса-Гельмгольца
|
|
Теорема Нернста. Формулювання третього начала термодинаміки. Наслідки із третього начала термодинаміки.
Теорема Нернста:
При прямуванні температури до абсолютного нуля, зміна ентропії прямує до деякої кінцевої межі, яка не залежить від значень параметрів, що визначають рівноважний стан системи.

 - Формулювання Планка.
- Формулювання Планка.
Дов. S=k*ln(G) – термодинамічна ймовірність (кількість мікростанів, через які можна представити даний мікростан)
(ɦw/2 – енергія нульових коливань, якою нехтують.)
Т = 0, k->G=1-> lnG =0 -> S=0.
Формулювання 1:
Абсолютний нуль недосяжний, адже тоді можна було б створити машину ККД якої рівна 100%.
 , Т2 = 0 ->
, Т2 = 0 ->  = 1 -> неможливо за ІІ началом термодинаміки
= 1 -> неможливо за ІІ началом термодинаміки
Формулювання 2 :Неможливо створити вічний двигун ІІІ роду.
 Наслідки 3 начала термодинаміки:
Наслідки 3 начала термодинаміки:
1). При наближенні температури до 0(К), будь-яка теплоємність прямує до 0.
V = const
бQ = CvdT
dS = бQ / T = CvdT / T;
S – S0 = 

S = S0 +  =
= 
 S =
S = 
Cv =  V =
V =  V =
V =  V Т -> 0, lnT -> -∞, Cv ->0.
V Т -> 0, lnT -> -∞, Cv ->0.
Cp = Cv + R – для ідеальних газів
2). При наближенні температури до абсолютного нуля, ізотерма співпадає з адіабатою:
PV = const,  ,
,
γ = (Cp / Cv) -> 1.
Метод термодинамічних потенціалів. Внутрішня енергія як термодинамічний потенціал. Співвідношення Максвела.
Метод термодинамічних потенціалів допомагає перетворювати вирази, в які входять основні термодинамічні величини, такі як кількість теплоти, ентропію, внутрішню енергію через величини, які можна поміряти – температуру, тиск та об’єм.
Якщо розглядати внутрішню енергію U Розглядати як потенціальну енергію, виражену через незалежні змінні S i V, то можна вважати вн. енергію термодинамічним потенціалом.
Тоді для U=U(S, V) отримуємо співвідношення Максвела 
Метод термодинамічних потенціалів. Вільна енергія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
Метод термодинамічних потенціалів допомагає перетворювати вирази, в які входять основні термодинамічні величини, такі як кількість теплоти, ентропію, внутрішню енергію через величини, які можна поміряти – температуру, тиск та об’єм.
Якщо розглядати вільну енергію F як величину, виражену через незалежні змінні V i T, то можна вважати вільну енергію термодинамічним потенціалом.
Тоді для F=F(V, T) отримуємо співвідношення Максвела 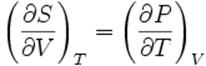 .
.
За рівнянням Гіббса-Гельмгольца вільна енергія визначається так:
 .
.
Метод термодинамічних потенціалів. Ентальпія як термодинамічний потенціал. Співвідношення Максвела і рівняння Гіббса-Гельмгольца.
Метод термодинамічних потенціалів допомагає перетворювати вирази, в які входять основні термодинамічні величини, такі як кількість теплоти, ентропію, внутрішню енергію через величини, які можна поміряти – температуру, тиск та об’єм.
Якщо розглядати ентальпію I як величину, виражену через незалежні змінні S i P, то можна вважати вільну енергію термодинамічним потенціалом.
Тоді для U=U(S, P) отримуємо співвідношення Максвела 
За рівнянням Гіббса-Гельмгольца ентальпія визначається так:  .
.
Метод термодинамічних потенціалів. Термодинамічний потенціал Гібса. Співвідношення Максвелла і рівняння Гібса-Гельмгольца.
Якщо процес квазістатичний, то  . Для такого процесу рівняння першого начала термодинаміки
. Для такого процесу рівняння першого начала термодинаміки 
Можна представити у вигляді 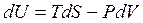
Якщо ввести ентальпію  , то можна виключити
, то можна виключити 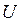 та отримати
та отримати 
В термодинаміку було введено дві важливі функції: вільна енергія F, введена Гельмгольцем, і термодинамічний потенціал G , введений Гібсом. Ці функції виражаються співвідношенням
F=U-TS (1), G=F+PV=U-TS+PV .(2)
Їх диференціали  При ізотермічному процесі dT=0, а тому dF = - PdV = - δA. Звідси A=F1-F2 .Отже, вільна енергія є функцією стану системи, втрати якої в квазистатичномуу процесі дають роботу, зроблену системою. Термодинамічний потенціал Гібса слід розглядати як функцію від T i P: G=G(T,P) (3). Такого роду співвідношення називається канонічним рівнянням стану речовини. Канонічне рівняння стану, містить повний обсяг інформації про термічні та калоричні властивості речовини.
При ізотермічному процесі dT=0, а тому dF = - PdV = - δA. Звідси A=F1-F2 .Отже, вільна енергія є функцією стану системи, втрати якої в квазистатичномуу процесі дають роботу, зроблену системою. Термодинамічний потенціал Гібса слід розглядати як функцію від T i P: G=G(T,P) (3). Такого роду співвідношення називається канонічним рівнянням стану речовини. Канонічне рівняння стану, містить повний обсяг інформації про термічні та калоричні властивості речовини.
 (4) З цього рівняння
(4) З цього рівняння  З означення функції F i G слідує U=F+TS, I=G+TS. Підставив вираз ентропії
З означення функції F i G слідує U=F+TS, I=G+TS. Підставив вираз ентропії  . Це рівняння називається рівнянням Гібса-Гельмгольца. Далі вторинним диференціюванням із співвідношення (4) знаходимо
. Це рівняння називається рівнянням Гібса-Гельмгольца. Далі вторинним диференціюванням із співвідношення (4) знаходимо  Це співвідношення називається співвідношенням Максвелла. Воно використовується для виводу різних співвідношень між величинами, що характеризують термодинамічно рівноважні стани системи. Такий метод називається методом термолинамічних потенціалів.
Це співвідношення називається співвідношенням Максвелла. Воно використовується для виводу різних співвідношень між величинами, що характеризують термодинамічно рівноважні стани системи. Такий метод називається методом термолинамічних потенціалів.
|
Просмотров 1295 |
|
|
