
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Критичний стан. Критичні параметри. Методи визначення критичних параметрів. Зведене рівняння Ван-дер-Вальса
|
|
При певних параметрах T,P існує тільки одне рішення рівняння Ван-дер-Ваальса. Така ізотерма наз. критичною, при цьому зникає різниця між газом і рідиною і цей стан речовини наз. критичним станом. Оцінити критичні параметри можна на підставі рівняння В-дер-В. Перепишемо його так:  , У критичній точці
, У критичній точці  ,
,  знайдемо це:
знайдемо це:  ,
,  , З цих двох рівнянь знаходимо критичні параметри:
, З цих двох рівнянь знаходимо критичні параметри:  ,
,  ,
,  . Щоб знайти сталі a, b для різних газів на експерименті фіксуються критичні параметри газів, бо теоретично отримати значення цих сталих з рівняння В-дер-В неможливо. Щоб перевірити правильність рівняння В-дер-В знайдемо величину
. Щоб знайти сталі a, b для різних газів на експерименті фіксуються критичні параметри газів, бо теоретично отримати значення цих сталих з рівняння В-дер-В неможливо. Щоб перевірити правильність рівняння В-дер-В знайдемо величину  . Експеримент дає такі значення: водень – 3,28; кисень – 3,42. Це розходження свідчить про те, що рівняння В-дер-В, яке виведено з припущення, що молекули – це тверді кулі, є неточним.
. Експеримент дає такі значення: водень – 3,28; кисень – 3,42. Це розходження свідчить про те, що рівняння В-дер-В, яке виведено з припущення, що молекули – це тверді кулі, є неточним.
Зведене рівняння. Треба отримати рівняння стану незалежно від природи газу, тобто універсальне. Будь-які гази з однаковим(відповідним) відношенням 
 ,
,  будуть описуватися ідентичними рівняннями. Параметри
будуть описуватися ідентичними рівняннями. Параметри  називають зведеними.
називають зведеними.  ,
,  ,
, 


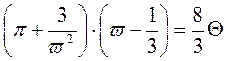
У даному рівнянні немає констант для окремих газів. Воно називається зведеним рівнянням стану. З нього випливає, що якщо гази мають два однакові зведені параметри з трьох, то й третій параметр для них однаковий. Цей закон називається законом відповідних станів.
Внутрішня енергія газу Ван – дер – Ваальса.
Ця енергія складається із внутрішньої енергії, які складають газ, і кінетичної енергії руху ценру мас молекул (СvT), і із потенціальної енергіївзаємного притягування молекул , яка має відємне значення. Потенціальна енергія протягування рівна роботі , яку необхідно затратити проти сил протягування для того, щоб розвести молекули на нескінчену відстань одної від одної, коли взаємодію між ними можна вважати відсутню, а потенціальну енергію взаємодії – рівну нулю. Тиск за рахунок притягання між молекуламив рівняні Ван-дер-Ваальса рівне а/V2, і звідси потенціальна енергія:
Еп = 
Внутрішня енергія газу Ван-дер Ваальса :
dU = CVdT + [T(dp/dT)v-p]dV
Із рівнянь Ван-дер-Ваальса:
p = RT/(V-b) – a/V2
T(dp/dT)v = RT/(V - b) = p + a/V2
dU = Cv dT + (a*dV)/V2
Вважаючи що U=0 при Т=0 і V=∞, отримаємо:
U = CVT-a/V, де СV не залежить від Т.
Ефект Джоуля-Томсона.
(62. Ефект Джоуля-Томпсона для газу Ван-дер-Ваальса. Температура інверсії. Пояснення єфекту; 63. Досліди Гей-Люссака, Джоуля і Томпсона по визначенню залежностей внутрішньої енергії газу від об”єму. Використання методу циклів для вирішення цієї задачі)
Еф.Д-Т полягає в зміні температури реального газу при його адіабатному дроселюванні (повільному протіканні газу крізь перешкоду, напр.. пористий корок) - розширенні без виконання роботи. При такому розширенні енергія газу залишається незмінною, а відбувається взаємний перехід між кінетичною і потенціальною її складовими. Якщо перед розширенням у газі переважало притягання молекул (потенціальна енергія при цьому була від‘ємною), то при значних розширеннях вона зростатиме за рахунок кінетичної енергії молекул і газ охолоджуватиметься (додатний еф.Д-Т). Якщо ж перед розширенням домінувало відштовхування молекул (потенціальна енергія додатна), то при розширенні вона зменшиться , а кінетична збільшиться і газ нагріється (від‘ємний еф.Д-Т). Той самий газ, залежно від тиску і температури, може виявити як додатний, так і від‘ємний еф.Д-Т. Той стан газу, при якому його розширення не веде до зміни температури (еф.Д-Т відсутній) наз. точкою інверсії, а температура, за якої Еф.Д-Т був відкритий у 1853 р. , застосовується при зрідженні газів. Щоб при черговому розширенні газ охолоджувався, його треба охолодити нижче від точки інверсії.  , де
, де  - температура охолодження газу,
- температура охолодження газу,  -початкова температура,
-початкова температура,  - об‘єм газу до розширення,
- об‘єм газу до розширення, 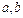 - сталі в рівнянні Ван-дер-Ваальса. При інверсії
- сталі в рівнянні Ван-дер-Ваальса. При інверсії  , отже температура інверсії знаходиться з рівняння:
, отже температура інверсії знаходиться з рівняння: 
Пояснення ефекту Д-Т: Для реального газу внутрішня енергія складається з кінетичної енергії молекул і потенціальної енергії їхньої взаємодії між собою. Потенціальна енергія знаходиться з рівняння Ван-дер-Ваальса  наступним чином:
наступним чином:  , отже для внутрішньої енергії реального разу
, отже для внутрішньої енергії реального разу  . відсутнє еф.Д-Т наз. температурою інверсії.Суть досліду полягає в тому, що збільшення кінетичної енергії молекул (отже і температури) відбувається за рахунок зміни потенціальної енергії взаємодії молекул. Внутрішня енергія газу залишається незмінною, а енергія перерозподіляється між першим і другим доданками. Ідея досліду: у добре ізольовану трубку поміщали пробку з вати. З одного боку від цієї пробки був газ під тиском
. відсутнє еф.Д-Т наз. температурою інверсії.Суть досліду полягає в тому, що збільшення кінетичної енергії молекул (отже і температури) відбувається за рахунок зміни потенціальної енергії взаємодії молекул. Внутрішня енергія газу залишається незмінною, а енергія перерозподіляється між першим і другим доданками. Ідея досліду: у добре ізольовану трубку поміщали пробку з вати. З одного боку від цієї пробки був газ під тиском  , а з другого під тиском
, а з другого під тиском  . Внаслідок різниці тисків газ протискувався через корок, розширюючись адіабатно. З обох боків пробки вимірювали температуру. Для більшості газів температура при цьому збільшувалась. “Протискування” газу через пробку вимагає витрат роботи
. Внаслідок різниці тисків газ протискувався через корок, розширюючись адіабатно. З обох боків пробки вимірювали температуру. Для більшості газів температура при цьому збільшувалась. “Протискування” газу через пробку вимагає витрат роботи  . Пізніше під час розширення газ сам виконує роботу
. Пізніше під час розширення газ сам виконує роботу  , причому
, причому  . В лівій частині рівняння газ можна вважати реальним, в правій частині – можна газ прийняти за ідеальний (спрощення). Для реального газу (ліва частина) матиме:
. В лівій частині рівняння газ можна вважати реальним, в правій частині – можна газ прийняти за ідеальний (спрощення). Для реального газу (ліва частина) матиме:  , а
, а  .
.
Прирівнюючи ці величини дістанемо рівняння з якого можна знайти 


|
Просмотров 1462 |
|
|
