
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Карбоновые кислоты ароматического ряда. Бензойная кислота. Фталевые кислоты. Понятие об окси-кислотах (молочная, лимонная, винная кислоты)
|
|
В большинстве ароматических кислот содержится по крайней мере одно бензольное кольцо. Многие ароматические карбоновые кислоты имеют тривиальные названия: С6Н5СООН – бензойная кислота, СН3С6Н4СООН – орто-, мета- и пара-толуиловые кислоты, пара-НООС–С6Н4–СООН – терефталевая кислота. Все эти кислоты – кристаллические соединения, слабо растворимые в воде и хорошо – в спирте. Ароматические кислоты сильнее предельных алифатических.
Бензойная кислота C6H5СООН — простейшая одноосновная карбоновая кислота ароматического ряда.
Бензойная кислота — бесцветные кристаллы, плохо растворимые в воде, хорошо — в этаноле и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой.
Фталевая кислота — простейший представитель двухосновных ароматических карбоновых кислот. Её соли и эфиры называют фталатами. Химическая формула С8H6O4.
Фталевая кислота имеет три изомера, отличающиеся друг от друга взаимным расположением карбоксильных групп -COOH:
бензол-1,2-дикарбоновая кислота (ортофталевая кислота, или фталевая кислота);
бензол-1,3-дикарбоновая кислота (метафталевая кислота, или изофталевая кислота);
бензол-1,4-дикарбоновая кислота (парафталевая кислота, или терефталевая кислота).
Орто-, мета- и парафталевые кислоты — бесцветные кристаллы, практически нерастворимые в воде, с температурой плавления, соответственно, 200 °C (разлагается на воду и фталевый ангидрид), 348 °C и 425 °C (в запаянном капилляре).
Молочная кислота (лактат) — α-оксипропионовая (2-гидроксипропановая) кислота.
tпл 25-26 °C оптически активная + или — форма.
tпл 18 °C рацемическая форма.
Молочная кислота образуется при молочнокислом брожении сахаров, в частности в прокисшем молоке, при брожении вина и пива. Химическая формула CH3CH(OH)COOH Эмпирическая формула C3H6O3
В пищевой промышленности используется как консервант, пищевая добавка E270.
Получают молочную кислоту молочнокислым брожением глюкозы (реакция ферментативна):
C6H12O6 → 2CH3CH(OH)COOH + 21,8·104 Дж
В Российской сельскохозяйственной промышленности на птицефабриках используется 80ти-процентный раствор для дезинфекции и чистки птичников.
Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) — кристаллическое вещество белого цвета, температура плавления 153 °C, хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Слабая трёхосновная кислота. Соли и эфиры лимонной кислоты называются цитратами. Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция), широко используется как вкусовая добавка, регулятор кислотности и консервант в пищевой промышленности (пищевые добавки E330—Е333), для производства напитков, сухих шипучих напитков.
Винная кислота (диоксиянтарная кислота, 2,3-дигидроксибутандиовая кислота) НООС-СН(ОН)-СН(ОН)-СООН — двухосновная оксикислота. Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, в аналитической химии для обнаружения альдегидов, сахаров и др. Соли винной кислоты (тартраты) используются в медицине, при крашении тканей и др.
Углеводы. Распространение в природе и значение в жизнедеятельности человека. Классификация. Моносахариды. Классификация. Строение гексоз. Таутомерия и мутаротация. Физические и химические свойства. Гликозиды. Понятие пентозах.
Углеводы — обширный класс природных соединений, которые играют важную роль в жизни человека, животных и растений. Общая формула Сn(Н2О)m
Углеводы относятся к числу наиболее распространенных в природе органических соединений: они являются компонентами клеток всех растительных и животных организмов. Углеводы образуются растениями в процессе фотосинтеза:
nСO2 + mН2O → Cn(H20)m + nO2
Животные не способны сами синтезировать углеводы и используют углеводы, синтезируемые растениями. Углеводы составляют значительную долю пищи млекопитающих.
В процессах дыхания происходит окисление углеводов, в результате чего выделяется энергия, необходимая для функционирования живых организмов: Cn(H20)m + O2 →nС02 +mH2O+энергия
Функции углеводов в живых организмах разнообразны. Они служат источником запасной энергии (в растениях — крахмал, в животных организмах — гликоген). В растительных организмах углеводы являются основой клеточных мембран. В качестве одного из структурных компонентов остатки углеводов входят в состав нуклеиновых кислот.
Классификация углеводов
Все углеводы можно разделить на две группы: простые углеводы, или моносахариды, и сложные углеводы.
Простые углеводы (моносахариды) — это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов.
Сложные углеводы — это углеводы, молекулы которых состоят из двух или большего числа остатков моносахаридов и разлагаются на эти моносахариды при гидролизе.
Моносахариды представляют собой соединения со смешанными функциями. Они содержат альдегидную или кетогруппу и несколько гидроксильных групп, т. е. являются альдегидоспиртами или кетоиоспнртами. Следовательно, углеводы являются полигидроксикарбонильнымисоединениями. Моносахариды с альдегидной группой называются альдозами, с кетогруппой — кетозами. По числу углеродных атомов в молекуле моносахариды делятся на тетрозы, пентозы, гексозы и т. д. Альдозы и кетозы с одинаковым числом атомов углерода изомерны между собой. Наибольшее значение среди моносахаридов имеют гексозы и пентозы.
Классификация моносахаридов

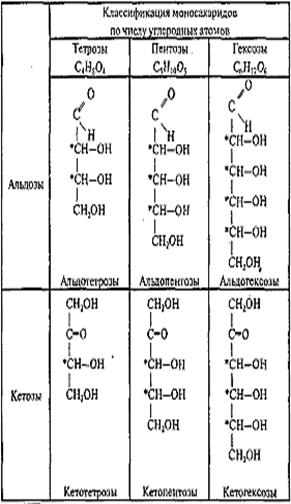
Гексозы, C6H12O6, простые сахара — моносахариды, содержащие 6 атомов углерода; в природе встречаются в свободном виде - в виде глюкозидов входят в состав ди- и полисахаридов,эфиров фосфорной кислоты,кликопротэинов.
Глюкоза может существовать в виде циклов (α и β глюкозы).
Таутомерия — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. При этом устанавливается таутомерное равновесие, и вещество одновременно содержит молекулы всех изомеров (таутомеров) в определённом соотношении. Чаще всего при таутомеризации происходит перемещение атомов водорода от одного атома в молекуле к другому и обратно в одном и том же соединении.
Мутаротация — изменение величины оптического вращения растворов оптически активных соединений вследствие их эпимеризации, в химии углеводов под мутаротацией обычно подразумевается эпимеризацияполуацетального атома углерода. Характерна для моносахаридов, восстанавливающих олигосахаридов, лактонов и др. Мутаротация может катализироваться кислотами и основаниями.
Физические свойства
Моносахариды представляют собой бесцветные кристаллические вещества, сладкие на вкус, хорошо растворимые в воде, нерастворимые в эфире, плохо растворимые в спирте. Сладость моносахаридов различна. Например, фруктоза слаще глюкозы в три раза.
Химические свойства
Моносахариды — это соединения со смешанными функциями.
В растворах существует динамическое равновесие между несколькими таутомерными формами моносахаридов, поэтому в зависимости от условий и реагентов они могут реагировать в открытой или циклической форме. При этом равновесие смещается в сторону образования той формы, которая вступает во взаимодействие.
Химические свойства моносахаридов обусловлены наличием:
а) карбонильной группы в открытых формах моносахаридов;
б) спиртовых гидроксильных групп как в открытых, так и в циклических формах моносахаридов;
в) полуацетальной гидроксильной группы в циклических формах моносахаридов.
Рассмотрим химические свойства моносахаридов на примере важнейшего из них — глюкозы.
Реакции с участием альдегидной группы глюкозы (т.е. свойства глюкозы как альдегида).
—Восстановление(гидрирование) с образованием многоатомного спирта.
В ходе этой реакции карбонильная группа >С=О восстанавливается и образуется новая спиртовая группа -ОН.
—Окисление
Глюкоза легко окисляется. В зависимости от характера окислителей получаются различные продукты.
1)Окисление под действием слабых (мягких) окислителей с образованием глюконовой кислоты.
2)Окисление под действием сильных окислителей (например, азотной кислоты HN03) с образованием двухосновной глюкаровой кислоты.
В ходе этой реакции и альдегидная группа —СНО и первичная спиртовая группа —СН2ОН окисляются до карбоксильных групп —СООН.
Реакции глюкозы с участием гидроксильных групп(т. е. свойства глюкозы как многоатомного спирта):
—Взаимодействие с Сu(ОН)2на холоду с образованием глюконата меди (II) (качественная реакция на глюкозу как многоатомный спирт).
—Взаимодействие с ангидридами или галогенангидридами кислот с образованием сложных эфиров.
—Взаимодействие с галогеналканамис образованием простых эфиров.
—Взаимодействие со спиртамис образованием гликозидов.
Гликозиды — это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения. В случае глюкозы гликозиды называются глюкозидами. Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С глюкозы связаны остатки самых различных соединений.
Брожение (ферментация) моносахаридов.
Брожение — это расщепление моносахаридов под влиянием биологических катализаторов — ферментов, вырабатываемых микроорганизмами.
Пентоза — общее родовое химическое название класса пятиуглеродных сахаров, то есть сахаров, общей формулой которых является C5(H2O)5, или C5H10O5. Широко распространены в природе, встречаются в свободном виде, входят в состав гликозидов, полисахаридов. Являются структурными компонентами нуклеиновых кислот.
Дисахариды. Классификация. Строение. Гидролиз дисахаридов. Инверсия сахарозы, ее промышленное значение. Полисахариды. Строение и свойства крахмала и целлюлозы, получение и промышленное использование производных целлюлозы. Понятие о пектиновых веществах.
Дисахариды — продукты конденсации двух моносахаридов.
Важнейшие природные представители: сахароза (тростниковый или свекловичный сахар), мальтоза (солодовый сахар), лактоза (молочный сахар), целдобиоза. Все они имеют одну и ту же эмпирическую формулу C12H22O11, т. е. являются изомерами.
Строение
1.Молекулы дисахаридов могут содержать два остатка одного моносахарида или два остатка разных моносахаридов.
2.Связи, образующиеся между остатками моносахаридов, могут быть двух типов:
а) Связь, в образовании которой принимают участие полуацетальные гидроксиды обеих молекул моносахаридов.
б) Связь, в образовании которой принимают участие полуацетальный гидроксил одного моносахарида и спирто-вый гидроксил другого моносахарида.
При гидролизе расщепляются на составляющие их моносахариды за счёт разрыва гликозидных связей между ними. Эта реакция является обратной процессу образования дисахаридов из моносахаридов.
Инверсия — гидролитическое расщепление сахарозы на глюкозу и фруктозу. Под влиянием кислот сахароза в водном растворе, присоединяя воду, распадается на глюкозу и фруктозу.
Полисахариды — высокомолекулярные и не сахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (обычно гексоз), связанных гликозидными связями.
Важнейшие природные представители: крахмал, гликоген, целлюлоза. Это природные полимеры (ВМС), мономером которых является глюкоза. Их общая эмпирическая формула (С6Н10О5)n.
Крахма́л (C6H10O5)n — полисахариды амилозы и амилопектина, мономером которых является альфа-глюкоза. Крахмал, синтезируемый разными растениями в хлоропластах, под действием света при фотосинтезе, несколько различается по структуре зёрен, степени полимеризации молекул, строению полимерных цепей и физико-химическим свойствам.
Физические и химические свойства
Безвкусный, аморфный порошок белого цвета, нерастворимый в холодной воде. Под микроскопом видно, что это зернистый порошок; при сжатии порошка крахмала в руке он издаёт характерный «скрип», вызванный трением частиц.
В горячей воде набухает (растворяется), образуя коллоидный раствор — клейстер; с раствором йода образует соединение-включение, которое имеет синюю окраску. В воде, при добавлении кислот (разбавленная H2SO4 и др.) как катализатора, постепенно гидролизуется с уменьшением молекулярной массы, с образованием т. н. «растворимого крахмала», декстринов, вплоть до глюкозы.
Молекулы крахмала неоднородны по размерам. Крахмал представляет собой смесь линейных и разветвлённых макромолекул.
При действии ферментов или нагревании с кислотами подвергается гидролизу. Уравнение:(C6H10O5)n + nH2O—H2SO4→ nC6H12O6.
Качественные реакции:
Крахмал, в отличие от глюкозы, не даёт реакции серебряного зеркала;
Подобно сахарозе, не восстанавливает гидроксид меди (II);
Взаимодействует с йодом (окрашивание в синий цвет).
Крахмал применяется в кондитерском производстве (получение глюкозы и патоки), является сырьем для производства этилового, н-бутилового спиртов, ацетона, лимонной кислоты, глицерина и т. д. Он используется в медицине в качестве наполнителей (в мазях и присыпках), как клеящее средство.
Целлюлоза — (C6H10O5)n, белое твердое вещество, нерастворимое в воде, молекула имеет линейное (полимерное) строение, структурная единица — остаток β-глюкозы [С6Н7О2(OH)3]n. Полисахарид, главная составная часть клеточных оболочек всех высших растений.
Физические свойства
Целлюлоза — белое твердое, стойкое вещество, не разрушается при нагревании (до 200 °C), но является горючим веществом. Температура воспламенения 275 °С, температура самовоспламенения 420 °С (хлопковая целлюлоза). Не растворима в воде и слабых кислотах.
Химические свойства
Целлюлоза состоит из остатков молекул глюкозы, которая и образуется при гидролизе целлюлозы:
(C6H10O5)n + nH2O nC6H12O6
Серная кислота с йодом, благодаря гидролизу, окрашивают целлюлозу в синий цвет. Один же йод — только в коричневый.
При реакции с азотной кислотой образуется нитроцеллюлоза (тринитрат целлюлозы).
В процессе этерификации целлюлозы уксусной кислотой получается ацетат целлюлозы:
Получение
Промышленным методом целлюлозу получают методом варки щепы на целлюлозных заводах, входящих в промышленные комплексы (комбинаты). По типу применяемых реагентов различают следующие способы варки целлюлозы:
Кислые: Сульфитный. Варочный раствор содержит сернистую кислоту и её соль, например гидросульфит натрия. Этот метод применяется для получения целлюлозы из малосмолистых пород древесины: ели, пихты.
Щелочные: Натронный. Используется раствор гидроксида натрия. Натронным способом можно получать целлюлозу из лиственных пород древесины и однолетних растений. Преимуществом данного метода — отсутствие неприятного запаха соединений серы, недостатки — высокая стоимость получаемой целлюлозы. Метод практически не используется.
Сульфатный. Наиболее распространенный метод на сегодняшний день. В качестве реагента используют раствор, содержащий гидроксид и сульфид натрия, и называемый белым щёлоком. Своё название метод получил от сульфата натрия, из которого на целлюлозных комбинатах получают сульфид для белого щёлока. Метод пригоден для получения целлюлозы из любого вида растительного сырья. Недостатком его является выделения большого количества дурно пахнущих сернистых соединений: метилмеркаптана, диметилсульфида и др. в результате побочных реакций.
Применение
Являясь составной частью древесины, целлюлоза используется в строительном и столярном деле и как топливо (горение идет с выделением энергии); из древесины получают бумагу и картон, этиловый спирт. В виде волокнистых материалов (хлопка, льна, конопли) целлюлоза используется для изготовления тканей, нитей; эфиры целлюлозы идут на изготовление нитролаков, кинопленок, бездымного пороха, пластмасс, медицинского коллодия, искусственного волокна.
Пектиновые вещества или пектины — полисахариды, образованные остатками главным образом галактуроновой кислоты. Присутствуют во всех высших растениях, особенно много во фруктах и в некоторых водорослях. Пектины, являясь структурным элементом растительных тканей, способствуют поддержанию в них тургора, повышают засухоустойчивость растений, устойчивость овощей и фруктов при хранении. Используются в пищевой промышленности — в качестве структурообразователей (гелеобразователей), загустителей, а также в медицинской и фармацевтической промышленности — в качестве физиологически активных веществ с полезными для организма человека свойствами. В промышленных масштабах получают пектиновые вещества в основном из яблочных и/или цитрусовых выжимок, жома сахарной свёклы, корзинок подсолнечника. Другие виды растительного сырья не имеют особого промышленного и прикладного значения.
Амины. Классификация, изомерия, номенклатура, получение. Физические и химические свойства (основность, алкилирование, ацилирование, действие азотистой кислоты). Понятие о диаминах.
Амины — это производные аммиака (NH3), в молекуле которого один, два или три атома водорода замещены углеводородными радикалами.
По числу углеводородных радикалов, замещающих атомы водорода в молекуле NH3, все амины можно разделить на три типа: 
Группа — NH2 называется аминогруппой. Существуют также амины, которые содержат две, три и более аминогрупп
Номенклатура
К названию органических остатков, связанных с азотом, добавляют слово «амин», при этом группы упоминают в алфавитном порядке: CH3NC3H — метилпропиламин, CH3N(C6H5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода. Для некоторых аминов используются тривиальные названия: C6H5NH2 — анилин (систематическое название — фениламин).
Для аминов возможна изомерия цепи, изомерия положения функциональной группы, изомерия между типами аминов
Физические свойства
Низшие предельные первичные амины — газообразные вещества, имеют запах аммиака, хорошо растворяются в воде. Амины с большей относительной молекулярной массой — жидкости или твердые вещества, растворимость их в воде с увеличением молекулярной массы уменьшается.
Химические свойства
По химическим свойствам амины похожи на аммиак.
1. Взаимодействие с водой — образование гидроксидов замещенного аммония.Раствор аммиака в воде обладает слабыми щелочными (основными) свойствами. Причина основных свойств аммиака — наличие у атома азота неподеленной электронной пары, которая участвует в образовании донорно-акцепторной связи с ионом водорода. По этой же причине амины также являются слабыми основаниями. Амины — органические основания.
2. Взаимодействие с кислотами — образование солей (реакции нейтрализации). Как основание аммиак с кислотами образует соли аммония. Аналогично при взаимодействии аминов с кислотами образуются соли замещенного аммония. Щелочи, как более сильные основания, вытесняют аммиак и амины из их солей.
3. Горение аминов. Амины являются горючими веществами. Продуктами горения аминов, как и других азотсодержащих органических соединений, являются углекислый газ, вода и свободный азот.
Алкилирование — введение алкильного заместителя в молекулу органического соединения. Типичными алкилирующими агентами являются алкилгалогениды, алкены, эпоксисоединения, спирты, реже альдегиды, кетоны, эфиры, сульфиды, диазоалканы. Катализаторами алкилирования являются минеральные кислоты, кислоты Льюиса а также цеолиты.
Ацилирование. При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:

Реакция с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды, реакция проводится в присутствии основания, чтобы связать образующийся HCl.
Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощи азотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты:
C2H5NH2 + HNO2 → C2H5OH + N2 +H2O
При этом выделяется газ (азот). Это признак того, что в колбе первичный амин.
Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Вторичные амины сложно не узнать, по лаборатории распространяется характерный запах нитрозодиметиламина.
Третичные амины при обычной температуре в азотистой кислоте просто растворяются. При нагревании возможна реакция с отщеплением алкильных радикалов.
Способы получения
1.Взаимодействие спиртов с аммиаком при нагревании в присутствии Аl203 в качестве катализатора.
2.Взаимодействие алкилгалогенидов (галогеналканов) с аммиаком. Образовавшийся первичный амин может вступать в реакцию с избытком алкилгалогенида и аммиака, в результате чего образуется вторичный амин. Аналогично могут быть получены третичные амины
ДИАМИНЫ, содержат в молекуле две аминогруппы.
19. Аминокислоты. Классификация, изомерия, номенклатура, получение. Физические и химические свойства. Амфотерные свойства, биполярная структура, изоэлектрическая точка. Полипептиды. Отдельные представители: глицин, аланин, цистеин, цистин, а-аминокапроновая кислота, лизин, глутаминовая кислота.
Аминокислоты — это производные углеводородов, содержащие аминогруппы (—NH2) и карбоксильные группы –СООН.
Общая формула: (NH2)fR(COOH)n где mи nчаще всего равны 1 или 2. Таким образом, аминокислоты являются соединениями со смешанными функциями.
Классификация

Изомерия
Изомерия аминокислот, как и гидроксикислот, зависит от изомерии углеродной цепи и от положения аминогруппы по отношению к карбоксилу (a-, β-и γ- аминокислоты и т.д.). Кроме того, все природные аминокислоты, кроме аминоуксусной, содержат асимметрические атомы углерода, поэтому они имеют оптические изомеры (антиподы). Различают D- и L-ряды аминокислот. Следует отметить, что все аминокислоты, входящие в состав белков, относятся к L-ряду.
Номенклатура
Аминокислоты обычно имеют тривиальные названия (например, аминоуксусная кислота называется иначе гликоколом или иицином, а аминопропионовая кислота — аланиноми т.д.). Название аминокислоты по систематической номенклатуре складывается из названия соответствующей карбоновой кислоты, производным которой она является, с добавлением в качестве приставки слова амино-. Положение аминогруппы в цепи указывается цифрами.
Способы получения
1.Взаимодействие α-галогенкарбоновых кислот с избытком аммиака.В ходе этих реакций происходит замещение атома галогена в галогенкарбоновых кислотах (об их получении см. § 10.4) на аминогруппу. Вьщеляющийся при этом хлороводород связывается избытком аммиака в хлорид аммония.
2.Гидролиз белков.При гидролизе белков обычно образуются сложные смеси аминокислот, однако с помощью специальных методов из этих смесей можно выделять отдельные чистые аминокислоты.
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворяются в воде, температура плавления 230—300°С. Многие α-аминокислоты имеют сладкий вкус.
Химические свойства

1. Взаимодействие с основаниями и с кислотами:
а) как кислота (участвует карбоксильная группа).
б) как основание (участвует аминогруппа).
2. Взаимодействие внутри молекулы — образование внутренних солей:
а) моноаминомонокарбоновые кислоты (нейтральные кислоты). Водные растворы моноаминомонокарбоновых кислот нейтральны (рН = 7);
б) моноаминодикарбоновые кислоты (кислые аминокислоты). Водные растворы моноаминодикарбоновых кислот имеют рН < 7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+;
в) диаминомонокарбоновые кислоты (основные аминокислоты). Водные растворы диаминомонокарбоновых кислот имеют рН > 7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН-.
3. Взаимодействие аминокислот друг с другом — образование пептидов.
4. Взаимодействуют со спиртами с образованием сложных эфиров.
Изоэлектрическая точка аминокислот, не содержащих дополнительных NH2- или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК':  соответственно для аланина
соответственно для аланина  .
.
Изоэлектрическая точка ряда других аминокислот, содержащих дополнительные кислотные или основные группы (аспарагиновая и глутаминовая кислоты, лизин, аргинин, тирозин и др.), зависит, кроме того, от кислотности или основности радикалов этих аминокислот. Для лизина, например, рI должна вычисляться из полусуммы значений рК' для α- и ε-NН2-групп. Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой.
Полипептиды содержат более десяти аминокислотных остатков.
Глицин (аминоуксусная кислота, аминоэтановая кислота) — простейшая алифатическая аминокислота, единственная аминокислота, не имеющая оптических изомеров. Эмпирическая формула C2H5NO2
Аланин (аминопропановая кислота) — алифатическая аминокислота. α-аланин входит в состав многих белков, β-аланин — в состав ряда биологически активных соединений. Химическая формула NH2 —CH —CH3 —COOH. Аланин легко превращается в печени в глюкозу и наоборот. Этот процесс носит название глюкозо-аланинового цикла и является одним из основных путей глюконеогенеза в печени.
Цистеин (α-амино-β-тиопропионовая кислота; 2-амино-3-сульфанилпропановая кислота) — алифатическая серосодержащая аминокислота. Оптически активна, существует в виде L- и D- изомеров. L-Цистеин входит в состав белков и пептидов, играет важную роль в процессах формирования тканей кожи. Имеет значение для дезинтоксикационных процессов. Эмпирическая формула C3H7NO2S.
Цисти́н (хим.) (3,3'-дитио-бис-2-аминопропионовая к-та, дицистеин) — алифатическая серосодержащая аминокислота, бесцветные кристаллы, растворимые в воде.
Цистин - некодируемая аминокислота, представляющая собой продукт окислительной димеризации цистеина, в ходе которой две тиольные группы цистеина образуют дисульфидную связь цистина. Цистин содержит две аминогруппы и две карбоксильных группы и относится к двухосновным диаминокислотам. Эмпирическая формула C6H12N2O4S2
В организме находятся в основном в составе белков.
Аминокапроновая кислота (6-аминогексановая кислота или ε-аминокапроновая кислота) — лекарственное гемостатическое средство, тормозит превращение профибринолизина в фибринолизин. Брутто-формула C6H13NO2.
Лизин (2,6-диаминогексановая кислота) — алифатическая аминокислота с выраженными свойствами основания; незаменимая аминокислота. Химическая формула: C6H14N2O2
Лизин входит в состав белков. Лизин — это незаменимая аминокислота, входящая в состав практически любых белков, необходима для роста, восстановления тканей, производства антител, гормонов, ферментов, альбуминов.
Глутаминовая кислота (2-аминопентандиовая кислота) — алифатическая аминокислота. В живых организмах глутаминовая кислота в виде аниона глутамата присутствуют в составе белков, ряда низкомолекулярных веществ и в свободном виде. Глутаминовая кислота играет важную роль в азотистом обмене. Химическая формула C5H9N1O4
Глутаминовая кислота также является нейромедиаторной аминокислотой, одним из важных представителей класса «возбуждающих аминокислот». Связывание глутамата со специфическими рецепторами нейронов приводит к возбуждению последних.
Простые и сложные белки. Пептидная связь. Понятие о первичной, вторичной, третичной и четвертичной структуре белковой молекулы. Типы связей, определяющих пространственное строение молекулы белка (водородные, дисульфидные, ионные, гидрофобные взаимодействия). Физические и химические свойства белков (реакции осаждения, денатурации, цветные реакции). Изоэлектрическая точка. Значение белков.
Белки — это природные высокомолекулярные соединения (биополимеры), структурную основу которых составляют полипептидные цепи, построенные из остатков α-аминокислот.
Простые белки (протеины) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот.
Сложные белки (протеиды) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа.
Пептидная связь —вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями.
Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Физические свойства
Свойства белков так же разнообразны, как и функции, которые они выполняют. Одни белки растворяются в воде,-образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Химические свойства
В радикалах аминокислотных остатков белки содержат различные функциональные группы, которые способны вступать во многие реакции. Белки вступают в реакции окисления-восстановления, этерификации, алкилирования, нитрования, могут образовывать соли как с кислотами, так и с основаниями (белки амфотерны).

Например, альбумин — яичный белок — при температуре 60—70° осаждается из раствора (свертывается), теряя способность растворяться в воде.
3. Цветные (качественные) реакции на белки:
а) ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца):
Белок + HNO3 (конц.)→ Желтое окрашивание 
б) биуретовая реакция (на пептидные связи): Белок + CuSО4(насыщ) + NaOH(конц)→ Ярко-фиолетовое окрашивание
в) цистеиновая реакция (на остатки аминокислот, содержащих серу):Белок + NaOH + Pb(CH3COO)2→ Черное окрашивание
Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды pH, при которой молекулы данного белка не несут электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI ~ 1, а для сальмина — белка-протамина молок лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Функции белков в организме
Белки являются основой всего живого на Земле и выполняют в организмах многообразные функции.
| 1. Пластическая | Строительный материал клетки |
| 2. Транспортная | Переносят различные вещества |
| 3. Защитная | Обезвреживают чужеродные вещества |
| 4. Энергетическая | Снабжают организм энергией |
| 5. Каталитическая | Ускоряют протекание химических реакций в организме |
| 6. Сократительная | Выполняет все виды движений, к которым способны клетки и организмы |
| 7. Регуляторная | Регулируют обменные процессы |
Существуют белки, выполняющие специфические функции, например рецепторные, — обеспечивают передачу импульсов между нервными клетками и др.
Белки — необходимая составная часть пищи человека, отсутствие или недостаток их в пище может вызвать серьезные заболевания.
|
Просмотров 2150 |
|
|
