
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Производные алкилуреидов сульфокислот (сульфонилмочевины)
|
|
В настоящее время известно более 15 000 сульфамидных производных, обладающих гипогликемическим действием. Идея их создания зародилась в результате изучения побочных эффектов сульфаниламидов, одним из которых было снижение содержания сахара в крови. Наибольшую гипогликемическую активность проявили сульфонилмочевины и их производные (сульфонилтиомочевины, сульфонилсемикарбазиды, сульфонилтиосемикарбазиды, сульфонамидомочевины), а также гетериламиды сульфокислот (сульфонамидооксадиазолы, сульфонамидотиадиазолы, сульфонамидопиримидины). Установлено также, что противодиабетическим действием обладают бигуаниды.
Общую формулу производных сульфонилмочевины можно представить следующим образом:

Гипогликемическое действие обусловливает наличие группы
 .
.
Замена SO2 на CO, PO, NH и CH2 или введение CH2-группы между SO2 и NH-группами приводит к потере активности.
Из замещённых сульфонилмочевины применяют карбутамид (букарбан), глибенкламид, глипизид (минидиаб), гликвидон (глюренорм), гликлазид (предиан).
Исходными продуктами синтеза алкилуреидов сульфокислот служат производные анилина или толуола. Синтез включает получение сульфаниламида, который затем сочетают с производными мочевины:

В частности, карбутамид синтезируют по схеме:

43.3. Свойства производных сульфонилмочевины
| Лекарственное вещество | Химическая структура | Описание |
| Carbutamide— карбутамид (Букарбан) | 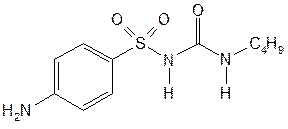 N-(n-аминобензолсульфонил)-
N’-бутилмочевина
N-(n-аминобензолсульфонил)-
N’-бутилмочевина
| Белый кристаллический порошок |
| Gliclazide— гликлазид (Предиан) | 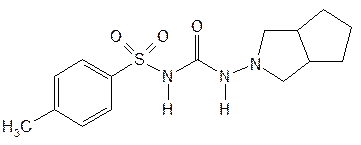 1-(3-азабицикло[3,3,0]-октил-3)-(п-толилсульфонил)мочевина
1-(3-азабицикло[3,3,0]-октил-3)-(п-толилсульфонил)мочевина
| Белый или беловатый кристаллический порошок. Т. пл. 162–166 °C |
| Glibenclamide— глибенкламид (Манинил) |  N-{4-[2-(5-хлор-2-метоксибензамидо)этил]-бензолсульфонил}-
N’-циклогексилмочевина
N-{4-[2-(5-хлор-2-метоксибензамидо)этил]-бензолсульфонил}-
N’-циклогексилмочевина
| Белый или белый с едва заметным кремоватым оттенком мелкокристаллический порошок без запаха. Т. пл. 167–171°C |
| Glipizide— глипизид (Минидиаб) | 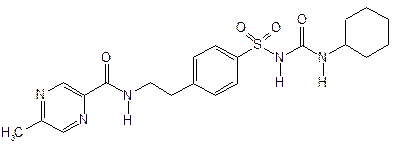 1-циклогексил-3-[пара-2-(5-метилпиразинкарбоксамид)этил]фенил]сульфонил] мочевина
1-циклогексил-3-[пара-2-(5-метилпиразинкарбоксамид)этил]фенил]сульфонил] мочевина
| Белый кристаллический порошок |
| Gliquidone— гликвидон (Глюренорм) |  1-циклогексил-3-[п-[2-(3,4-дигидро-7-метокси-4,4-диметил-1,3-диоксо-2(1H)-изохинолил)этил]фенил]-сульфонилмочевина 1-циклогексил-3-[п-[2-(3,4-дигидро-7-метокси-4,4-диметил-1,3-диоксо-2(1H)-изохинолил)этил]фенил]-сульфонилмочевина
| Белый кристаллический порошок |
Производные сульфонилмочевины (табл. 43.3) представляют собой белые кристаллические вещества (глибенкламид может иметь кремоватый оттенок). Они практически нерастворимы в воде, растворимы или мало растворимы в этаноле. Гликлазид растворим в этилацетате, умеренно растворим в ацетоне, легко — в дихлорметане. Глибенкламид умеренно растворим в хлороформе, легко растворим в диметилформамиде. Ввиду наличия в молекулах сульфамидной группы, растворы в этаноле и диметилформамиде проявляют кислотные свойства. Указанные лекарственные вещества растворимы в растворах щелочей.
Для идентификации алкилуреидов сульфокислот (гликлазида, глипизида, глибенкламида и др.) используют ИК-спектроскопию. ИК-спектры лекарственных веществ, растертых в вазелиновом масле, регистрируют в области 4000–650 см–1. Они должны соответствовать спектрам стандартных образцов.
Подлинность производных сульфонилмочевины можно установить методом спектрофотометрии в УФ-области по расположению максимумов поглощения и по удельному показателю поглощения. Раствор карбутамида в этаноле имеет максимум при 269 нм, в 0,1 М растворе хлороводородной кислоты — при 266 и 272 нм, а в 0,1 М растворе гидроксида натрия — при 255 нм. УФ-спектр раствора гликлазида имеет максимум поглощения при 228 нм, раствора глибенкламида в метаноле — три максимума (227, 273 и 293 нм), наибольшее значение удельного показателя поглощения (597) при длине волны 227 нм. Для подтверждения подлинности глипизида и гликвидона устанавливают идентичность УФ-спектров поглощения спектрам стандартных образцов этих лекарственных веществ.
Подлинность глипизида устанавливают также методом ВЭЖХ по времени удерживания испытуемого вещества, которое должно быть сопоставимым со временем удерживания стандарта.
Для подтверждения подлинности гликвидона используют метод ТСХ. Основное пятно на хроматограмме должно соответствовать по расположению и интенсивности флуоресценции основному пятну стандартного образца.
Методом ВЭЖХ в гликлазиде устанавливают допустимое содержание примесей (не более 0,2%) других производных сульфонилмочевины. Примесь остаточных растворителей (этилацетата) определяют методом ГЖХ.
Подлинность производных сульфонилмочевины устанавливают также с помощью химических реакций. Использование многих из них рассмотрено на примере идентификации сульфаниламидных препаратов, имеющих в молекулах атом серы и те же функциональные группы.
При нагревании карбутамида в растворе гидроксида калия происходит гидролиз с образованием аммиака, который можно обнаружить по запаху или по изменению окраски лакмусовой бумаги:

Аналогичный химический процесс происходит при испытании в тех же условиях глибенкламида, гликлазида и др.
Реакция гидролиза происходит также при кипячении производных сульфонилмочевины с разбавленной серной кислотой. Последующее добавление 30%-ного раствора гидроксида натрия приводит к выделению жирных капель аминов, имеющих характерный запах. После более продолжительного нагревания (10–30 мин) в присутствии 50%-ной серной кислоты (с обратным холодильником), последующего охлаждения и нейтрализации выделяется осадок сульфамида. Общая схема гидролиза карбутамида, гликлазида, глибенкламида в кислой среде:

Наличие серы устанавливают после спекания со смесью карбоната и нитрата калия. Затем плав растворяют в хлороводородной кислоте и в фильтрате открывают сульфат-ион. В том же фильтрате обнаруживают хлорид-ионы, образующиеся при разрушении глибенкламида. Сульфамидную группу в глибенкламиде обнаруживают по образованию комплексного соединения с ионом меди (II), выпадающего в виде осадка зеленовато-голубого цвета. Из раствора карбутамида в этаноле под действием сульфата меди (II) выпадает окрашенный мелкокристаллический осадок, который постепенно обесцвечивается.
Карбутамид при нагревании с 0,2%-ным раствором нингидрина в бутиловом спирте приобретает фиолетовое окрашивание. Карбутамид и глибенкламид могут быть идентифицированы с помощью цветных и микрокристаллоскопических реакций. В качестве реактивов для этой цели используют 10%-ный раствор иодида калия, 5%-ный раствор хлорида кадмия, железо- и медноиодидный комплексы, 1%-ный раствор в этаноле a-нафтола в присутствии концентрированной серной кислоты.
При взаимодействии указанных лекарственных веществ с аллоксаном в присутствии солей кальция образуются окрашенные производные пурпуровой кислоты. Эту реакцию используют в среде диметилформамида для спектрофотометрического определения при длине волны 480 нм.
Раствор карбутамида в хлороводородной кислоте с раствором фосфорномолибденовой кислоты в азотной кислоте образует осадок в виде желто-зеленых хлопьев, которые постепенно превращаются в мелкие кристаллы. Карбутамид дает ряд других реакций, подтверждающих его подлинность. При пиролизе его кристаллов выделяется аммиак, а плав приобретает фиолетово-красный цвет. После обработки плава этанолом раствор окрашивается в красновато-фиолетовый цвет. При нагревании кристаллов карбутамида и резорцина с 1 мл серной кислоты смесь окрашивается в темно-красный цвет, после разбавления водой и добавления щелочи появляется желто-зеленая флуоресценция.
Карбутамид отличается от других производных сульфонилмочевины наличием первичной ароматической аминогруппы в молекуле. Способы его испытаний по этой функциональной группе такие же, как и при анализе сульфаниламидов. Для испытания подлинности используют реакцию диазотирования и азосочетания с b-нафтолом в щелочной среде. Появляется красное окрашивание.
Количественное определение карбутамида выполняют по первичной ароматической аминогруппе нитритометрическим методом, устанавливая точку эквивалентности с помощью потенциометра, внешнего или внутренних индикаторов. Карбутамид можно количественно определять и бромид-броматометрическим методом.
Количественное определение гликлазида и глибенкламида выполняют методом кислотно-основного титрования, используя кислотные свойства растворов, обусловленные наличием сульфамидной группы. В качестве растворителя применяют диметилформамид, титрантом служит раствор гидроксида натрия (калия), индикатором — тимолфталеин. Ниже представлен химизм происходящего процесса:

Реакцию минерализации производных сульфонилмочевины до образования сульфат-иона используют для количественного определения. Озоление производят в колбе с кислородом в присутствии 0,1 М раствора хлорида бария и пероксида водорода. Избыток титранта устанавливают титрованием 0,1 М раствором серной кислоты (индикатор родизонат натрия) в водно-спиртовой среде в присутствии буферного раствора (pH 4,0).
Известна методика обратного меркуриметрического титрования после минерализации глибенкламида по хлорид-иону. Избыток титранта — раствора нитрата ртути (II) после отфильтровывания осадка титруют в фильтрате тиоцианатом аммония (индикатор железоаммониевые квасцы).
Количественное определение гликлазида выполняют методом неводного титрования в среде безводной уксусной кислоты, используя в качестве титранта 0,1 М раствор хлорной кислоты, устанавливая конечную точку потенциометрическим методом. Этим методом количественно определяют и другие производные сульфонилмочевины.
Метод ВЭЖХ используют для количественного определения глипизида по стандартному образцу. Подвижной фазой служит буферный раствор (водные растворы мононатрийфосфата и гидроксида натрия до pH 6) в смеси с метанолом (55:45). Детектируют на спектрофотометре при длине волны 225 нм.
Гликвидон и другие производные сульфонилмочевины в лекарственных формах количественно определяют методом УФ-спектрофотометрии в указанных выше максимумах поглощения.
Хранят лекарственные вещества в сухом, защищённом от света месте, при температуре до 25 °C. Большинство из них относятся к списку Б.
Производные сульфонилмочевины стимулируют образование инсулина b-клетками поджелудочной железы, понижая при этом содержание сахара в крови. Назначают при различных формах сахарного диабета в виде таблеток; карбутамид по 0,5 г, глибенкламид по 0,005 г, гликлазид по 0,08 г, глипизид по 0,005 и 0,01 г, гликвидон по 0,03 г.
Производные гуанидина
В 70-х годах было установлено, что наряду с производными сульфонилмочевины противодиабетическим действием обладают также не содержащие сульфоксильного радикала вещества, в т.ч. производные бигуанида:

Производным бигуанида является метформин (табл. 43.4).
Синтезируют метформин из диметиламина гидрохлорида и дициандиамида:

43.3. Свойства метформина
| Лекарственное вещество | Химическая структура | Описание |
| Metformin— метформин (Глиформин) |  N’, N’-диметилбигуанида гидрохлорид
N’, N’-диметилбигуанида гидрохлорид
| Мелкокристаллический порошок белого цвета, без запаха. Гигроскопичен |
Метформин легко растворим в воде (допускается опалесценция), мало и медленно растворим в этаноле, практически нерастворим в эфире.
ИК-спектр метформина, снятый после прессования в виде таблеток с бромидом калия, в области 2000-400 см–1 по положению и относительным интенсивностям полос должен полностью совпадать с приложенным к ФС рисунком спектра.
Для испытания подлинности и количественного определения метформина используют УФ-спектрофотометрию. Водный раствор должен иметь максимум поглощения в области 233 нм. В этом максимуме определяют и его количественное содержание. Расчёт ведут по удельному показателю поглощения (782).
Подлинность метформина в таблетках подтверждают методом ТСХ на пластинке, покрытой силикагелем в системе: н-бутанол-ледяная уксусная кислота-вода (4:1:5). Сравнивают Rf испытуемого метформина и стандартного образца. Этим же методом на пластинке, покрытой целлюлозой в системе растворителей ацетон-бензол-вода (12:6:1) устанавливают допустимое содержание примеси исходного продукта синтеза — дициандиамида (не более 0,04%).
Выполняют также испытание на хлорид-ионы и цветную реакцию с 1-нафтолом и гипохлоритом натрия в щелочной середе. Раствор окрашивается в оранжево-красный цвет, темнеющий при стоянии.
Хранят метформин по списку Б в сухом, защищённом от света месте.
В отличие от производных сульфонилмочевины, метформин не усиливает секрецию инсулина, а угнетает глюконеогенез в печени, периферическую утилизацию глюкозы, тормозит всасывание сахара в кишечнике. Метформин снижает содержание сахара, триглицеридов и холестерина только у больных сахарным диабетом. Назначают в таблетках по 0,25 г.
|
Просмотров 9803 |
|
|
