
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Циклоалканы. Средние циклы. Циклопентан. Циклогексан. Циклогептан. Конформационная изомерия циклогексана. Химические свойства
|
|
В циклопентане угловое напряжение отс., но появл. торсионное напряж. Почти все атомы водорода нах. в заслон. положении. Конформация циклопентана-конверт. В конформации циклогексана «кресло» нет напряж. (ни угл., ни торсион.). Шестичленные циклы особенно устоёчивы и широко распр. в природе. Исходя их этого Мор обосновал предположение, что в циклогексановое кольцо им. не плоское строение и может принимать 2 формы: кресла и ванны. C5H10 £=0, Q=159; C6H12 £=-5◦, Q=157. Первонач. счит., что углеводор. атомы циклов расп. в одной плоскости. Отсюда вытек., что валентные углы в циклах равны. В циклопропане 60◦, в циклобутане 90◦, в циклопентане 108◦, в циклогексане 120◦. Байер высказал предположение, что при отклонении валентнтых углов цикла возник. напряжённость, т.е. возрастает энергия мол-лы. Мерой напряжён. Байер предложил счит. половину разности между тетраэдрическим углом и валентным углом плоского кольца (£). Однако, при изуч. теплот сгорания были получены др. данные: наим. теплотой сгорания (в расчёте на 1 гр. CH2) облад. циклогексан. Эти данные объясняли, что в циклогексане не должно быть отклонен. валентных углов от тетраэдрич. Хим. св-ва завис. от размера цикла. Циклопентан и циклогексан сходны со св-вами предельных углеводородов (р. замещ.).
Алкены. Строение. Природа двойной связи.Изомерия структурная и пространственная. Способы получения. Химические свойства. Реакции ионого и радикального присоединения кратных связей. Реакции присоединения к алкенам: гидрирование, галогенирование, гидрогалогенирование, гидратация. Окисление, озонирование алкенов. Реакции полимеризации алкенов.
Алке́ны (олефины, этиленовые углеводороды) —ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp²-гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). Названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой. Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2— «аллил». Алкены, число атомов углерода, в которых больше двух, (т.е. кроме этилена) имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная. Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии. Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает. Алкены могут существовать в виде пространственных или геометрических изомеров. Различают: цис- изомеры: заместители расположены по одну сторону от двойной связи; транс- изомеры: заместители расположены по разные стороны от двойной связи. В соответствии с теорией гибридизации двойная связь образуется за счет перекрывания вдоль линии связи С-С sp²-гибридных орбиталей атомов углерода (σ- связь) и бокового перекрывания углеродных p-орбиталей (π-
связь). Все атомы этилена лежат в одной плоскости, а величина валентного угла связи C-H практически равна 120°. Центры углеродных атомов в этилене находятся на расстоянии 0,134 нм, то есть длина двойной связи несколько короче, чем С-С. Согласно теории молекулярных орбиталей линейная комбинация двух атомных 2p-орбиталей углерода формирует две молекулярные π-орбитали этилена. Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа. Для производства низших алкенов используют также реакцию дегидратации соответствующих спиртов.
В лабораторной практике обычно применяют метод дегидратации спиртов в присутствии сильных минеральных кислот, дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных; синтезы Гофмана, Чугаева, Виттига и Коупа. Дегидрирование алканов Это один из промышленных способов получения алкенов. Температура: 350—450 °C, катализатор — Cr2O3. Также используются алюмомолибденовые и алюмоплатиновые катализаторы: CH3-CH3→CH2=CH2+H2.Дегидрогалогенирование и дегалогенирование алканов Отщепление галогенов у дигалогеналканов происходит в присутствии цинка: R-CHCl-CH2-Cl+Zn→R-CH=CH2+ZnCl2. Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей: R-CHBr-CH3+C2H5ONa→R-H=CH2+NaBr+C2H5OH. При отщеплении галогенводорода образуется смесь изомеров,преобладающий из которых определяется правилом Зайцева: отщепление протона происходит от менее гидрогенизированного атома углерода. Гидрирование алкинов Частичное гидрирование алкинов требует специальных условий и наличие катализатора (например, дезактивированного палладия — катализатора Линдлара): CH3-C≡C-CH3+H2→Pd/Pb(CH3COO)2 CH3-CH=CH-CH3 (цис-изомер); CH3-C≡C-CH3+2Na+2NH3→CH3-CH=CH-H3+2NaNH2 (транс-изомер). Химические свойства Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны. Особенностью алкенов являются также реакции циклоприсоединения. Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению. Реакции электрофильного присоединения В данных реакциях атакующей частицей является электрофил. Галогенирование Галогенирование алкенов, проходящее в отсутствие инициаторов радикальных реакций—типичная реакция электрофильного присоединения. Она проводится в среде неполярных инертных растворителей (например: CCl4): R-CH=CH2+Br2→R-CHBr-CH2Br. Реакция галогенирования стереоспецифична—присоединение происходит с противоположных сторон относительно плоскости молекулы алкена. Механизм реакций подобноготипа в общем виде:

Гидрогалогенирование Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:


Однако в присутствии перекисей присоединение происходит против этого правила (эффект Караша):

Это объясняется тем, что реакция в данном случае будет протекать по радикальному механизму:

Гидратация Реакция присоединения воды к алкенам протекает в присутствии серной кислоты:R-CH=CH2+H2O→ R-CH(OH)-CH3. Реакция протекает по правилу Марковникова. Реакции радикального присоединения В условиях, способствующих гомолитическому разрыву связи, (высокая температура, облучение, наличие свободных радикалов и пр.) присоединение к алкенам происходит по радикальному механизму. Гидрирование R-CH=CH-R’+H2→R-CH2-CH2-R’. Гидрирование алкенов непосредственно водородом происходит только в присутствии катализатора. Гетерогенными катализаторами гидрирования служат платина, палладий, никель. Гидрирование можно проводить и в жидкой фазе с гомогенными катализаторами (например: катализатор Уилкинсона ((C6H5)3P)3Rh Cl). В качестве реагентов гидрирования могут выступать диимид (NH=NH), диборан (B2H6). Реакции радикального замещения При высоких температурах (более 400 °C) реакции радикального присоединения, носящие обратимый характер, подавляются. В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи: CH3-CH=CH-CH3+Cl2→ClCH2-CH=CH2+HCl. Реакция носит радикальный характер и протекает аналогично хлорированию алканов. Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета. Окисление неорганическими окислителями 1)В мягких условиях возможно окисление посредством присоединения по двойной связи двух гидроксильных групп: R-CH=CH-R+OsO4+2H2O→R-CH(OH)-CH(OH)-R+OsO2(OH)2. На первом этапе происходит присоединение оксида осмия к алкену, затем под действием воосстановителя ( Zn или NaHSO3) образовавшийся комплекс переходит к диолу (Реакция Криге). Аналогично реакция идет в нейтральной или слабощелочной среде под действием KMnO4 (Реакция Вагнера): 3CH2=CH2+2KMnO4+4H2O→3CH2OH-CH2OH+2KOH+2MnO2. 2) При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи: R-CH=CH-R+[O]→2R-COOH. Окисление в присутствии солей палладия В присутствии солей палладия этилен окисляется до ацетальдегида: 2CH2=CH2+O2→2CH3CHO. Реакция идет в кислой среде и является промышленным способом получения ацетальдегида. Озонолиз алкенов обычно проводят при низких температурах (от −80 до −30 °C) в инертном растворителе (гексан, тетрахлорметан, хлороформ, этилацетат и пр.). Непосредственные продукты озонолиза не выделяют, а подвергают дальнейшему гидролизу, окислению или восстановлению. 1)Озонолиз в мягких условиях: алкен окисляется до альдегидов (в случае монозамещенных вицинальных углеродов), кетонов (в случае дизамещенных вицинальных углеродов) или смеси альдегида и кетона (в случае три-замещенного у двойной связи алкена). На первой стадии происходит присоединение озона с образованием озонида. Далее под действием восстановителя (например: Zn + CH3COOH) озонид разлагается:

Если взять более сильный восстановитель, скажем—алюмогидрид лития, продуктом реакции будут спирты. 2) Озонолиз в жёстких условиях — алкен окисляется до кислоты: R’-CH=CH-R”+O3→R’-COOH+R”-COOH+H2O. В данном случае разложение озонида происходит под действием окислителей ( пероксид водорода, оксид
серебра). Реакции полимеризации Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионному механизму. По первому методу получают полиэтилен высокого давления: n CH2=CH2→ -[-CH2-CH2-]n-. Катализатором реакции выступают пероксиды. Второй метод предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений (катализаторы Циглера-Натта, анионная полимеризация). Преимуществом метода является возможность получения стереоселективных полимеров.
Алкадиены. Классификация и строение диеновых углеводородов. Кумулены. Аллены: воображение о строении и химических свойствах. 1,3-диены (сопряженные диены). Особенности реакций присоединения, продукты 1,2- и 1,4-присоединения. Реакции гидрирования, галогенирования, гидрогалогенирования. Реакция Дильса-Альдера. Реакции полимеризации.
Алкадиены — класс углеводородов, содержащих две двойных связи углерод-углерод. В зависимости от взаимного расположения двойных связей диены подразделяются на три группы:сопряженные диены, в которых двойные связи разделены одинарной (1,3-диены) аллены с кумулированными двойными связями (1,2-диены) диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными. Гетероаналоги диенов, в которых один из ненасыщенных углеродных атомов замещён гетероатомом, называются гетеродиенами. Обычно к диенам относят ациклические и циклические 1,3-диены, образующие гомологические ряды общих формул CnH2n-2 и соответственноCnH2n-4, ациклические диены являются структурными изомерами алкинов. Центральный sp-гибридизованный атом углерода в алленах является электрофильным центром, поэтому, в отличие от не активированных электронакцепторными заместителями алкенов, аллены реагируют с мягкими нуклеофилами, образуя винильные и аллильные производные: CH2=C=CH2 + PhSH→CH2=C(SPh)-CH3 + CH2=CH-CH2SPh. Электрофильность sp-гибридизованного атома алленов повышается электроноакцепторными группами, в этом случае присоединение нуклеофила идет исключительно по этому атому:CH2=C=CHCOOR + NuH→CH2=CNuCH2COOR+CH3C(Nu)=CHCOOR Гидратации аллена в условиях кислотного катализа присоединение протона идёт по терминальному углероду, образующийся при этом енол далее таутомеризуется в ацетон: CH2=С=CH2 + H2O→[CH2=С(OH)CH3]→CH3COCH3 Под действием щелочей или кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены: RCH2CH=C=CH2→RCH=CHCH=CH2. Реакции 1,3-диенов Специфика реакционной способности 1,3-диенов обусловлена мезомерией вследствие сопряжения двойных связей:

Результатом является то, что в случае электрофильного присоединения к сопряженным диенам типичны реакции 1,4- присоединения, идушие через промежуточное образование резонансно стабилизированных аллильных карбокатионов: CH2=CH-CH=CH2 + X+→XCH2-CH=CH-CH2+ ;XCH2-CH=CH-CH2+ + Y- →XCH2-CH=CH-CH2Y; Х = Hal, H, Y = Hal, OH. Сопряженные диены легко полимеризуются по механизму 1,4-присоединения, реакция полимеризации 1,3-диенов лежат в основе синтеза диеновых каучуков. Диены также реагируют с алкенами и другими соединениями - диенофилами с активированной электронакцепторными заместителями кратной связью, образуя продукты [4+2]-присоединения (реакция Дильса — Альдера):

Алкины. Строение. Изомерия. Номенклатура. Физические свойства. Способы получения. Химические свойства. Реакции присоединения: гидрирование, галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
Алки́ны— углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения , алкины могут вступать также и в реакции нуклеофильного присоединения . Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения. Простейшим алкином является этин (ацетилен C2H2). По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами. Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил». Различают внутреннюю тройную связь (пример: бут-2-ин) и концевую (пример: бут-1-ин). Структура тройной связи У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль. Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях. Методы получения Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод. Карбидный метод (промышленный способ) Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:CaO+3C→CaC2+CO. При действии на полученный карбид воды образуется гидроксид кальция и ацетилен. Крекинг природного газа (промышленный способ) Электрокрекинг Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением. Термоокислительный крекинг В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании: 6CH4+4O2→C2H2+8H2+3CO+CO2+3H2O. Алкилирование алкинов с концевой тройной связью производится по следующей схеме:

Химические свойства Кислотные свойства алкинов и реакции нуклеофильного замещения Образование алкинидов Алкины с концевой тройной связью являются С-H кислотами (сильнее чем аммиак и алкены, но слабее, чем спирты) которые с очень сильными основаниями могут образовывать соли—алкиниды: HC≡CH+2NaNH2→ NaC≡CNa+2NH3 (ацетиленид динатрия); 2HC≡CH+2K→2HC≡CK+H2 (ацетиленид калия). Реакция алкинов с аммиакатами серебра или одновалентной меди является качественной на наличие концевой тройной связи: CH3-C≡CH+Ag(NH3)2OH→CH3-C≡CAg↓+2NH3+H2O;CH3-C≡CH+Cu(NH3)2 OH→CH3-C≡Cu↓ +2NH3+H2O. Алкинид серебра легко растворяется при добавлении цианида натрия с выделением соответствующего алкина: CH3-C≡CAg+2NaCN+H2O→CH3-C≡CH↑+Na [Ag(CN)2]+NaOH. Реакции электрофильного замещения алкинидов Алкиниды являются сильными нуклеофилами и легко вступают в реакции нуклеофильного замещения: NaC≡CNa+2H2O→HC≡CH+2NaOH. Получение алкингалогенидов Действием галогена на монозамещенные ацетилены в щелочной среде можно получить галогеналкины: CH3-C≡CH+Br2+NaOH→CH3-C≡C-Br+NaBr+ H2O. Реакция нуклеофильного замещения алкинидов: CH3-C≡C-MgBr +Br-CH2-CH=CH2→CH3-C≡C-CH2-CH=CH2+MgBr2. В препаративном синтезе часто используют комплекс ацетиленида лития с этилендиамином как удобный источник ацетиленид-аниона. Следует отметить, что в случае реакции с вторичными или третичными галогеналканами реакция во многом идет по альтернативному пути (элиминирование): CH3-C≡C-MgBr+CH3-CHBr-CH3→CH3-C≡CH+CH3-CH=CH2. Реакции электрофильного присоединения Электрофильное присоединение к алкинам инициируется под воздействием положительно заряженной частицы—электрофила. В общем случае, катализатором таких реакций являются кислоты. Общая схема первой стадии реакции электрофильного присоединения:

Реакции галогенирования Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:CH≡CH+Cl2→CHCl=CHCl; CHCl=CHCl+Cl2→CHCl2-CHCl2. Галогенирование алкинов идет как транс-присоединение (как правило) и протекает по аналогии с галогенированием алкенов. Вместе с тем, присоединение по тройной связи идет труднее, чем по двойной, в связи с чем при наличии в соединении как двойной, так и тройной связи, возможно провести избирательное присоединение. Реакции гидрогалогенирования Присоединение хлороводорода и бромоводорода к алкинам происходит по аналогии с алкенами. Реакция идет в две стадии: сперва образуется галогеналкен, который далее переходит в дигалогеналкан:

Несмотря на бо́льшую электроотрицательность галогенов, обе стадии реакции идут по правилу Марковникова. Это объясняется возникновением p-сопряжения между атомами галогена и водорода. Как видно из схемы, в результате реакции присоединения образуются транс- изомеры. Гидратация В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов). Эта реакция известна как реакция Кучерова. Считается, что процесс гидратации идет через стадию образования енола:
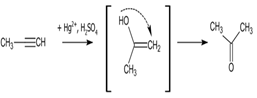
Реакции гидрирования Гетерогенное гидрирование Гидрирование алкинов водородом на гетерогенных катализаторах, как правило, приводит к образованию цис-присоединения. Катализаторами гидрирования служат Ni, Pd, Pt, а также оксиды или комплексы Ir, Ru, Rh и некоторых других металлов. На первой стадии образуется алкен, который практически сразу же гидрируется до алкана:

Для остановки реакции на стадии получения алкена используют катализаторы Линдлара (Pd/PbO/CaCO3) или борид никеля. Гомогенное гидрирование проводят в амидом натрия в жидком аммиаке или алюмогидридом лития в тетрагидрофуране. В ходе реакции образуются транс-алкены.
Окисление алкинов. C-H-кислотность. Реакции подвижного водородного атома. Присоединение терминальных алкинов к альдегидам и кетонам (реакция Фаворского)Реакции полимеризации алкинов. Получение. Применение.
Реакции окисления Реакции окислительного присоединения Алкины окисляются более трудно чем алкены, однако при контролируемом окислении можно сохранить C-C связь и получить в качестве продуктов реакции карбонильные соединения: RC≡CR+2[O]→R-C(O)-C(O)-R. В качестве окислителя может выступать озон (с последующим восстановлением и гидролизом озонида), KMnO4 в слабощелочной или нейтральной среде и некоторые другие вещества. Ацетилен, в зависимости от окислителя может давать три продукта: HC≡CH+2[O]→CHO-CHO (глиоксаль)—окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2; HC≡CH+3[O]→CHO-COOH (глиоксалевая кислота)—окисление KClO3 в субстрате вода+диэтиловый эфир; HC≡CH+4[O]→HOOC-COOH (щавелевая кислота)—окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2. Отдельный тип реакций—реакции оксилительного карбоксилирования. Реакции окислительного расщепления При действии сильных окислителей в жестких условиях алкины окисляются с разрывом тройной связи. В ходе реакции образуются карбоновые кислотыи CO2: RC≡CH+4[O]→RCOOH+CO2. Реакции оксилительного сочетания В присутствии солей одновалентной меди в спиртовом растворе аммиака алкины окисляются кислородом воздуха до диацетиленов (Реакция Глазера): 4RC≡CH+O2→2RC=C-C=CR+2H2O. Реакции полимеризации Впервые полимеризацию ацетилена осуществил Дж. Натта в 1957 году, пропуская газ над раствором катализатора Al(C2H5)3-Ti(OC4H9)4. В ходе реакции был получен полукристаллический полиацетилен. Полиацетилен интересен тем, что введением в него определенных добавок (допирование) можно получить электропроводящий полимер сметаллическими свойствами. Применение Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Ацетилен использует для синтеза следующих продуктов: тетрахлорэтан, трихлорэтилен, дихлорэтилен (хлорирование ацетилена)—растворители; акрилонитрил (конденсация ацетилена с циановодородом) — для получения полиакрилонитрила; акриламид (конденсация ацетилена с CO и аммиаком)—для получения полиакриламида; тетрагидрофуран (конденсация ацетилена с формальдегидом с последующим гидрированием и дегидратацией)—важный растворитель, сырье для уретановых полимеров; винилхлорид (гидрохлорирование ацетилена) — для получения поливинилхлорида; винилацетат (конденсация суксусной кислотой) — для получения поливинилацетата; ацетальдегид (гидратация ацетилена)—для дальнейшего получения уксусной кислоты, ацетона и др. продуктов; бутиленгликоль (конденсация ацетилена с формальдегидом с последующим гидрированием) — дляполучения полиуретанов,полиэфиров, пластификаторов. винилацетилен (димеризация ацетилена)—полупродукт для синтеза полимеров; хлоропрен (гидрохлорирование винилацетилена) — для получения хлоропреновых каучуков; бутадиен (дегидратация бутиленгликоля)—для получения бутадиеновых каучуков; При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке(расходуется до 30 % всегопроизводимого ацетилена). В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники
(источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение. Методы получения Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод. Карбидный метод (промышленный способ) Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:CaO+3C→CaC2+CO. При действии на полученный карбид воды образуется гидроксид кальция и ацетилен. Крекинг природного газа (промышленный способ) Электрокрекинг Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением. Термоокислительный крекинг В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании: 6CH4+4O2→C2H2+8H2+3CO+CO2+3H2O. Алкилирование алкинов с концевой тройной связью производится по следующей схеме:

Вторая особенность электронного строения алкинов — повышенная полярность ацетиленовой связи С—Н. Она обусловлена следующими причинами. Известно, что 2s-электроны в среднем Расположены ближе к ядру, чем 2p- электроны. Орбитали ацетиленового атома углерода (sp-гибридные орбитали) содержат значительно больший вклад p-характера, чем sp3-и sp2-орбитали. Это приводит к увеличению электронной плотности вблизи атома углерода. Если такой атом образует за счет sp-орбитали связь, то в ней, соответственно, электронная плотность сдвинута в сторону атома углерода (по сравнению с такой же связью, образованной sp3-гибридизованным атомом). Иными словами можно сказать, что у sp-гибридизованного атома углерода электроотрицательность выше, чем у sp3- и sp2-гибридизованных атомов. Соответственно, у алкинов с тройной связью на конце цепи (терминальных алкинов) соответствующая связь С-Н более полярна, чем в алкенах и алканах, и имеет слабокислотный характер. Реакция Фаворского 1. Ацетилен-алленовая перегруппировка. Катализируемая сильными основаниями перегруппировка алкинов в аллены и миграция двойной связи в углеродной цепи была открыта А.Е Фаворским в 1888 г. Он получал бутин-1 дегидрогалогенированием 2,2- дихлорбутана под действием спиртового раствора КОН в ампуле при 170 °C. Неожиданно вместо бутина-1 был получен бутин-2. CH3-CH2-C≡CH↔[CH3-CH=C=CH2]↔CH3-C≡C-CH3 2. Присоединение карбонильных соединений к алкинам. В присутствии сильных оснований алкины с концевой тройной связью способны присоединять карбонильные соединения с образованием спиртов: CH3-C≡CH + CH3-CO-CH3 → CH3-C≡C-C(OH)(CH3)2 3. конденсация алкинов со спиртами. Реакция нуклеофильного присоединения спиртов к алкинам в присутствии щелочей с образованием алкенильных эфиров: CH3-C≡CH + CH3CH2OH → CH3-C(OC2H5)=CH2.
Полимеры. Реакции полимеризации алкенов и алкадиенов. Типы полимеризации и катализаторы. Примеры радикальной, катионной и анионной полимеризации. Понятие о стереорегулярных полимерах. Полиэтилен, полипропилен, поливинилхлорид (ПВХ). Получение бутадиенового каучука. Изопрен. Каучук и гуттаперча (пространственное строение, промышленная переработка, вулканизация, резина).
Полиме́ры —неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере (степень полимеризации) должно быть достаточно велико. Во многих случаях количество звеньев может считаться достаточным, чтобы отнести молекулу к полимерам, если при добавлении очередного мономерного звена молекулярные свойства не изменяются. Как правило, полимеры — вещества с молекулярной массой от нескольких тысяч до нескольких миллионов. Если связь между макромолекулами осуществляется с помощью слабых сил Ван-Дер-Ваальса, они называются термопласты, если с помощью химических связей — реактопласты. К линейным полимерам относится, например, целлюлоза, к разветвлённым, например, амилопектин, есть полимеры со сложными пространственными трёхмерными структурами. В строении полимера можно выделить мономерное звено — повторяющийся структурный фрагмент, включающий несколько атомов. Полимеры состоят из большого числа повторяющихся группировок (звеньев) одинакового строения, например поливинилхлорид (—СН2—CHCl—)n, каучук натуральный и др. Высокомолекулярные соединения, молекулы которых содержат несколько типов повторяющихся группировок, называют сополимерами или гетерополимерами. Полимер образуется из мономеров в результате реакций полимеризации или поликонденсации. К полимерам относятся многочисленные природные соединения: белки, нуклеиновые кислоты, полисахариды, каучук и другие органические вещества. Большое число полимеров получают синтетическим путём на основе простейших соединений элементов природного происхождения путём реакций полимеризации, поликонденсации и химических превращений. Названия полимеров образуются из названия мономера с приставкой поли-: полиэтилен, полипропилен, поливинилацетат и т. п. Полимериза́ция —процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества ( мономера, олигомера) к активным центрам в растущей молекуле полимера. Механизм полимеризации обычно включает в себя ряд связанных стадий: инициирование—зарождение активных центров полимеризации; рост (продолжение) цепи—процесс последовательного присоединения молекул мономеров к центрам; передача цепи — переход активного центра на другую молекулу; разветвление цепи—образование нескольких активных центров из одного; обрыв цепи — гибель активных центров. Виды полимеризации В основу классификации полимеризации могут быть положены различные признаки: число типов молекул мономеров: гомополимеризация—полимеризация одинаковых мономеров; сополимеризация— полимеризация двух и более разных мономеров. природа активного центра и механизм процесса: радикальная
полимеризация—активными центрами являются свободные радикалы; ионная полимеризация—активные центры ионы или поляризованные молекулы; фазовое состояние мономеров:газофазная полимеризация; жидкофазная полимеризация; твердофазная полимеризация.структура области, в которой сосредоточены активные центры: объемная полимеризация—полимеризация во всем объёме мономера; фронтальная полимеризация— экзотермическая полимеризация в узком фронте, распространяющемся в среде мономера; эмульсионная полимеризация—полимеризация на поверхности высокодиспергированных частиц мономера в эмульсии.способ инициирования: фотополимеризация; термическая полимеризация; радиационная полимеризация и др.. структурные особенности полученного полимера: стереорегулярная полимеризация—полимеризация с образованием полимеров с упорядоченной пространственной структурой; технологические особенности полимеризации: полимеризация при высоком давлении и др., химическая природа мономеров: полимеризация олефинов и др. Стереорегулярные полимеры-высокомол. соед., макромолекулы к-рых состоят из определенным способом соединенных между собой звеньев с одинаковым или разным, но закономерно периодически повторяющимся расположением атомов в пространстве. Конфигурация звена макромолекулы определяется пространств. расположением заместителей вокруг центров стереоизомерии-тетраэдрич. атома С, двойной связи или цикла. При одинаковой конфигурации звеньев макромолекула может иметь множество конформаций. Тетраэдрич. атомы С в осн. цепи всех полимеров виниловых мономеров, имеющие в качестве двух эквивалентных заместителей отрезки осн. цепи бесконечной длины, не являются истинно асимметрическими. Истинно асимметрич. тетраэдрич. атомы С в осн. цепи полимера должны быть связаны не менее чем с тремя разными по строению группами в каждом мономерном звене, как, напр., в молекулах полипропиленоксида [—О—СН(СН3)—]n и полипептидов (—NH—CHR—СО —)n. Такие макромолекулы могут существовать в виде двух энантиомеров, или оптич. антиподов. Упорядоченное расположение эквивалентных центров стереоизомерии в осн. цепи, т. е. ее стерич. упорядоченность, наз. тактичностью. В каждом звене макромолекулы м.б. один или неск. центров стереоизомерии. Если имеется упорядоченность по отношению к одной или двум группам центров, молекула наз. соотв. моно- и дитактической. Полимер, в к-ром отсутствует к.-л. упорядоченность пространств. расположения всех центров стереоизомерии в главной цепи, наз. атактическим. Полимер, в к-ром каждое звено содержит один центр стереоизомерии и конфигурации этих центров одинаковы, наз. изотактическим. Полимер, в к-ром каждое мономерное звено содержит один центр стереоизомерии, но соседние центры имеют противоположные конфигурации, наз. синдиотактическим. В нек-рых случаях разл. типы стереорегулярности могут многократно реализовываться в пределах одной макроцепи. Последовательность звеньев с одинаковой конфигурацией наз. блоком, а полимер рассматриваемого строения-стереоблочным. Реальный полимер не бывает полностью изо- или синдиотактическим. К стереорегулярным полимерам относят НК (1,4-цис-полиизопрен), гуттаперчу (1,4-транс-полиизопрен), целлюлозу и нек-рые ее производные. Полиэтиле́н—термопластичный полимер этилена . Является органическим соединением и имеет длинные молекулы …—CH 2—CH2—CH2— CH2—…, где «—» обозначает ковалентные связи между атомами углерода. Самый распространённый в мире пластик. Представляет собой воскообразную массу белого цвета (тонкие листы прозрачны и бесцветны). Химически- и морозостоек, изолятор, не чувствителен к удару (амортизатор), при нагревании размягчается (80—120°С), при охлаждении застывает, адгезия (прилипание) — чрезвычайно низкая. Полиэтилен высокого давления (ПЭВД), или Полиэтилен низкой плотности (ПЭНП), образуется при следующих условиях: температура 200—260 °C; давление 150—300 МПа; присутствие инициатора (кислород или органический пероксид); в автоклавном или трубчатом реакторах. Реакция идёт по радикальному механизму. Получаемый по этому методу полиэтилен имеет средневесовой молекулярный вес 80 000—500 000 и степень
кристалличности 50-60 %. Жидкий продукт впоследствии гранулируют. Реакция идёт в расплаве. Полиэтилен среднего давления (ПЭСД) образуется при следующих условиях: температура 100—120 °C; давление 3—4 МПа; присутствие катализатора (катализаторы Циглера — Натта, например, смесь TiCl4 и AlR3); продукт выпадает из раствора в виде хлопьев. Получаемый по этому методу полиэтилен имеет средневесовой молекулярный вес 300 000—400 000, степень кристалличности 80-90 %. Полиэтилен низкого давления (ПЭНД), или Полиэтилен высокой плотности (ПЭВП), образуется при следующих условиях: температура 120—150 °C; давление ниже 0.1 — 2 МПа; присутствие катализатора (катализаторы Циглера—Натта, например, смесь TiCl4 и AlR3); Полимеризация идёт в суспензии по ионно- координационному механизму. Получаемый по этому методу полиэтилен имеет средневесовой молекулярный вес 80 000—3 000 000, степень кристалличности 75-85 %. Общие свойства Устойчив к действию воды, не реагирует с щелочами любой концентрации, с растворами нейтральных, кислых и основных солей, органическими и неорганическими кислотами, даже концентрированной серной кислоты, но разлагается при действии 50%-ой азотной кислоты при комнатной температуре и под воздействием жидкого и газообразного хлора и фтора. При комнатной температуре нерастворим и не набухает ни в одном из известных растворителей. При повышенной температуре (80 °C) растворим в циклогексане и четырёххлористом углероде. Под высоким давлением может быть растворён в перегретой до 180 °C воде.Со временем, деструктурирует с образованием поперечных межцепных связей, что приводит к повышению хрупкости на фоне небольшого увеличения прочности. Нестабилизированный полиэтилен на воздухе подвергается термоокислительной деструкции (термостарению). Термостарение полиэтилена проходит по радикальному
механизму, сопровождается выделением альдегидов, кетонов, перекиси водорода и др. Полиэтилен низкого давления (ПЭНД), или высокой плотности (HDPE), применяется при строительстве полигонов переработки отходов, накопителей жидких и твёрдых веществ, способных загрязнять почву и грунтовые воды. Переработка
Полиэтилен (кроме сверхвысоко молекулярного)перерабатывается всеми известными для пластмасс методами, такими как экструзия, экструзия с раздувом, литьё под давлением, пневматическое формование. Экструзия полиэтилена возможна на оборудовании с установленным «универсальным» червяком. Полиэтиленовая плёнка (особенно упаковочная, например, пузырчатая упаковка или скотч), Тара (бутылки, банки, ящики, канистры, садовые лейки, горшки для рассады) Полимерные трубы для канализации, дренажа, водо-, газоснабжения. Электроизоляционный материал. Полиэтиленовый порошок используется как термоклей. Броня (бронепанели в бронежилетах) Корпуса для лодок, вездеходов, деталей технической аппаратуры, диэлектрических антенн, предметов домашнего обихода и др.; Малотоннажная марка полиэтилена — так называемый «сверхвысокомолекулярный полиэтилен», отличающийся отсутствием каких-либо низкомолекулярных добавок,
высокой линейностью и молекулярной массой, используется в медицинских целях в качестве замены хрящевой ткани суставов. Полипропилен (ПП)—это термопластичный полимер пропилена (пропена). Полипропилен получают полимеризацией пропилена в присутствии металлокомплексных катализаторов, например, катализаторов Циглера—Натта (например, смесь TiCl4 и AlR3): nCH2=CH(CH3) → [-CH2-CH(CH3)-]n Параметры, необходимые для получения полипропилена близки к тем, при которых получают полиэтилен низкого давления. При этом, в зависимости от конкретного катализатора, может получаться любой тип полимера или их смеси. Полипропилен выпускается в виде порошка белого цвета или гранул с насыпной плотностью 0,4—0,5 г/см³. Полипропилен выпускается стабилизированным, окрашенным и неокрашенным. Полипропилен имеет более высокую температуру плавления, чем полиэтилен, и соответственно более высокую температуру разложения. Основные способы переработки — формование методами экструзии, вакуум- и пневмоформования, экструзионно-выдувного, инжекционно-выдувного, инжекционного, компрессионного формования, литье под давлением. Применение Материал для производства плёнок (особенно упаковочных), мешков, тары, труб, деталей технической аппаратуры, предметов домашнего обихода, нетканых материалов и др.; электроизоляционный материал, в строительстве для вибро- и шумоизоляции межэтажных перекрытий в системах «плавающий пол». При сополимеризации пропилена с этиленом получают некристаллизующиеся сополимеры, которые проявляют свойства каучука, отличающиеся повышенной химической стойкостью и сопротивлением старению. Для вибро- и теплоизоляции также широко применяется пенополипропилен (ППП). Близок по характеристикам к пенополиэтилену. Также встречаются декоративные экструзионные профили из ППП, заменяющие пенополистирол. Атактический полипропилен используют для изготовления строительных клеев, замазок, уплотняющих мастик, дорожных покрытий и липких пленок. Поливинилхлорид—бесцветная,
прозрачная пластмасса, термопластичный полимер винилхлорида. Отличается химической стойкостью к щелочам, минеральным маслам, многим кислотам и растворителям. Не горит на воздухе, но обладает малой морозостойкостью (−15 °C). Нагревостойкость: +65 °C. Химическая формула: [-CH2-CHCl-]n. Молекулярная масса 9—170 тыс.; плотность — 1,35—1,43 г/см³. При температурах выше 110—120 °C склонен кразложению с выделением хлористого водорода HCl. Растворяется в циклогексаноне, тетрагидрофуране, диметилформамиде, дихлорэтане, ограниченно — в бензоле, ацетоне. Не растворяется в воде, спиртах, углеводородах; стоек в растворах щелочей, кислот, солей. Получается суспензионной или эмульсионной полимеризацией винилхлорида , а также полимеризацией в массе. Применяется для электроизоляции проводов и кабелей, производства листов,
труб (преимущественно хлорированный поливинилхлорид), пленок, пленок для натяжных потолков, искусственных кож, поливинилхлоридного волокна, пенополивинилхлорида, линолеума, обувных пластикатов, мебельной кромки и т. д. Также применяется для производства грампластинок (т. н. виниловых), профилей для изготовления окон и дверей. Поливинилхлорид также часто используется в одежде и аксессуарах для создания подобного коже материала, отличающегося гладкостью и блеском. Поливинилхлорид используют как уплотнитель в бытовых холодильниках, вместо относительно сложных механических затворов. Это дало возможность применить магнитные затворы в виде намагниченных эластичных вставок, помещаемых в баллоне уплотнителя. Моющиеся обои покрываются плёнкой из ПВХ с лицевой стороны, делая обои непромокаемыми. Также находит широкое применение в пиротехнике как донор хлора, необходимого для создания цветных огней.
Широко применяется в рекламе: для оформления витрин магазинов и торговых точек, создания рекламных баннеров и плакатов. Cлужит сырьём для производства различного рода продукции от грампластинок и плакатов до наклеек. Изопрен СН2=С(СН3)-СН=СН2, 2-метилбутадиен-1,3—ненасыщенный углеводород диенового ряда (CnH2n−2). В нормальных условиях бесцветная жидкость. Он является мономером для натурального каучука и структурной единицей для множества молекул других природных соединений—изопреноидов, или терпеноидов. Растворим в спирте. Изопрен полимеризуется, давая изопреновые каучуки. Изопрен также вступает в реакцию полимеризации с соединениями винилового ряда. Натуральный каучук является полимером изопрена—наиболее часто цис-1,4-полиизопреном с молекулярной массой от 100,000 до 1,000,000. В качестве примесей содержит несколько процентов других материалов, таких как белки, жирные кислоты, смолы и неорганические вещества.
Некоторые источники натурального каучука называются гуттаперча и состоит из транс-1,4- полиизопрена, структурный изомер, который имеет схожие, но не идентичные свойства. В основном, изопрен наиболее часто встречающийся углеводород находящийся в теле человека. Изопрен накапливается и помогает стабилизировать
мембраны клеток в ответ на термический стресс, давая некоторую толерантность к термическим ожогам. Изопрен может также давать некоторую устойчивость к реактивным кислородным веществам. Получение Метод Лебедева:2CH3-CH2-OH -> CH2=CH-CH=CH2 + 2H2O + H2 (при t=425гр., с AL2O3 и ZNO) Способ дегидрирования двухстадийное каталитическое дегидрирование н-бутана CH3-CH2-CH2-CH3→CH2=CH-CH=CH2 + 2H2 получение изопрена из 2-метилбутана H3C-CH(CH3)-CH2 CH3→(t=600)H2C=C(CH3)-CH=CH2+H2 2-метилбутан изопрен Дивинил и изопрен в небольших количествах так жевыделяют из продуктов пиролиза нефти. Изопрен применяют для получения синтетического каучука. Каучу́ки — натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты. Высокомолекулярный углеводород (C5H8)n, цис-полимер изопрена; В воде, спирте, ацетоне натуральный каучук практически не набухает и не растворяется. Уже при комнатной температуре натуральный каучук присоединяет кислород, происходит окислительная деструкция (старение каучука), при этом уменьшается его прочность и эластичность. При температуре выше 200 °C натуральный каучук разлагается с образованием низкомолекулярных углеводородов. При взаимодействии натурального каучука с серой, хлористой серой, органическими пероксидами (вулканизация) происходит соединение через атомы серы длинных макромолекулярных связей с образованием сетчатых структур. Это придает каучуку высокую эластичность в широком интервале температур. Натуральный каучук перерабатывают в резину. Первым синтетическим каучуком, имевшим промышленное значение, был полибутадиеновый (дивиниловый) каучук, производившийся синтезом по методу С. В. Лебедева (анионная полимеризация жидкого бутадиена в присутствии натрия), однако из-за невысоких механических качеств нашёл ограниченное применение. Бутадиеновый каучук получают из метана. Механизм анионной цепной полимеризации 1,3-бутадиена в присутствии бутиллия. Бутиллий, будучи высокополярным соед., легко распадается на ионы: C4H9Li→C4H9–+Li+ . Возбуждение цепи: C4H9–+CH2=CH-CH=CH2→C4H9-CH2-CH=CH-–CH2; рост цепи: C4H9-CH2-CH=CH-–CH2→nCH2=CH-CH=CH2→C4H9-[CH2-CH=CH-CH2]nCH2-CH=CH-–CH2; обрыв цепи: C4H9-[CH2-CH=CH-CH2]nCH2-CH=CH-–CH2→Li+→ C4H9-[CH2-CH=CH-CH2]nCH2-CH=CH-CH2Li. Степень полимеризации–примерно 100-1000 мономерных звеньев. В настоящее время большая часть производимых каучуков является бутадиен-стирольными или бутадиен-стирол-акрилонитрильными сополимерами. Эластичность и упругость каучуку придаёт так наз. вулканизация–дополнительная термическая обработка в присутствии до 8% серы. Сера «сшивает» полимерные цепи, образуя мостики по аллильномууглероду и двойным связям и превращ. липкий каучук в эластичный продукт. Повышение сод. серы приводит к образ. твёрдых каучуков (эбонитов).
Арены. Ароматичность, критерии ароматичности. Правило Хюккеля. Небензоидные ароматические системы: циклопропенилий- и циклогептатриенил-катиона (катиона тропилия) тропилий-катионы, циклопентадиенильный анион, азулен. Природа связей в молекуле бензола. Реакции SЕ2 (нитрование, сульфирование, галогенирование, алкилирование хлоралканом и алкеном). Реакции присоединения (гидрирование, хлорирование).
Бензол и его многочисленные производные обладают рядом особенностей. Совокупность этих свойств известна под названием "ароматический характер" или "ароматичность". Главной особенностью ароматических углеводородов является равномерное распределение π-электронной плотности в молекуле. Единая устойчивая замкнутая система π-электронов в циклической молекуле – основной признак ароматичности. Необходимым условием для такой делокализации π-электронов является строгая параллельность осей 2р-орбиталей, участвующих в образовании замкнутой π-электронной системы. Поэтому молекулы ароматических соединений обязательно имеют плоское строение. Если же это условие не выполняется, то круговое сопряжение π-электронов нарушается, как например, в молекуле циклооктатетраена. В результате это соединение не является ароматическим. Для ароматических соединений характерно также определенное число π-электронов в молекуле. Немецкий химик-теоретик Э.Хюккель вывел пр а в и ло (1931): плоские циклические соединения, имеющие сопряженную систему π-электронов, могут быть ароматическими, если число этих электронов равно 4n + 2 (где п = 0, 1, 2, 3 и т.д.). Другими словами, в ароматических соединениях может содержаться 2, 6, 10, 14 π-электронов и т.д. Это правило строго выполняется только для моноциклических соединений. Эти особенности строения объясняют многие свойства ароматических веществ. Например, они вступают преимущественно в реакции замещения, а не присоединения, несмотря на формальную ненасыщенность. Кроме того, ароматические соединения обладают высокой термодинамической устойчивостью. Бензол (бензен) С6Н6 – родоначальник обширного ряда углеводородов, которые называют ароматическими. Строение молекулы бензола обычно представляют циклической структурой. Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,140 нм. Это расстояние является средним между длинами одинарной (0,154 нм) и двойной (0,134 нм) связей. В одной плоскости с кольцом лежат и шесть связей С–Н, каждая из которых образует с ребром шестиугольника угол, равный 120°. Каждый углеродный атом в молекуле бензола находится в состоянии sр2-гибридизации. Он связан тремя своими гибридными орбиталями с двумя соседними атомами углерода и одним атомом водорода, образуя три s-связи. Четвертая – негибридизованная 2р-орбиталь атома углерода, ось которой перпендикулярна плоскости бензольного кольца, перекрывается с 2р-орбиталями двух соседних углеродных атомов (справа и слева). Такое пepeкрывание происходит над и под плоскостью кольца. В результате образуется единая замкнутая π-электронная система. При этом возникшее сопряжение осуществляется полнее, чем в бутадиене –1,3. Две области наибольшей π-электронной плотности расположены по обе стороны кольца (область всех s-связей). В результате равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей. Другими словами, в молекуле бензола С–С-связи не похожи на обычные простые или двойные связи, характерные для алканов и алкенов. Этим можно объяснить тот факт, что при обычных условиях бензол не вступает в реакции, характерные для непредельных углеводородов. Энергия связи С–С в молекуле бензола составляет 490 кДж/моль. Эта величина является также средней между энергиями одинарной и двойной связей. 8 Равномерное распределение π-электронной плотности между всеми углеродными атомами, обусловленное сопряжением, является причиной высокой устойчивости молекулы бензола. Реальная молекула бензола отличается от структуры, выраженной формулой Кекуле, на 150,7 кДж/моль. Эта величина является мерой устойчивости бензола. Поэтому С–С - связи в его молекуле обладают повышенной прочностью. Это сказывается на химическом поведении бензола. Так, при химических реакциях бензол проявляет высокую
устойчивость к окислителям, нагреванию, к реакциям присоединения и т.д. Реакции замещения Выравненность π-электронной плотности в ароматическом кольце способствует реакциям замещения, а не присоединения. Подвижные π-электроны, экранирующие бензольное кольцо, способны активно взаимодействовать с атакующими электрофильными реагентами. Другими словами, для ароматических углеводородов предпочтительными будут реакции электрофильного замещения (SЕ). В них участвует как само бензольное ядро, так и связанная с ним боковая цепь. Механизм реакции электрофильного замещения в ароматическом ряду
носит в большинстве случаев ионный характер и является трехстадийным. Первой стадией электрофильного замещения является образование π-комплекса в результате взаимодействия π-электронной системы бензольного кольца с положительно заряженной частицей Х+:

При этом атакующая частица связывается со всеми шестью π-электронами кольца. Вторая стадия состоит в переходе π-комплекса в s-комплекс. Это происходит в результате выделения из системы шести π-электронов двух электронов для образования новой ковалентной связи С—X. Оставшиеся четыре π-электрона распределяются между пятью углеродными атомами бензольного кольца:

В общем виде s-комплекс обычно изображают так:

Разорванная окружность в цикле означает прерванное π-сопряжение электронов. s-комплекс – промежуточное образование, представляющее собой неустойчивый карбкатион (но более устойчивый, чем π-комплекс), лишенный ароматичности. Шесть его углеродных атомов находятся в различных валентных состояниях: один, с которым связан заместитель X, – насыщенный (в состоянии sр3-гибридизации), а пять других – в обычном для бензола втором валентном состоянии (sp2). Заместитель X и атом водорода при насыщенном углеродном атоме расположены в плоскости, перпендикулярной плоскости бензольного кольца. Третья стадия–быстрое отщепление протона от s-комплекса:

Освобождающаяся при этом пара электронов (от связи С-Н) восполняет электронный пробел в кольце, и углерод из состояния sp3 переходит в состояние sр2-гибридизации. Отщепившийся протон связывается с анионом Y-:

По этому механизму протекают все реакции электрофильного замещения в бензольном ядре – галогенирование, нитрование, сульфирование, реакции алкилирования и ацилирования. В зависимости от условий одни и те же реагенты могут взаимодействовать и с ароматическим ядром, и с боковой цепью. Направление атакующего реагента зависит от условий реакции. Реакции электрофильного замещения в ароматическом ряду В своих типичных реакциях бензольное кольцо служит источником электронов, т.е. основанием. Вещества, с которыми оно реагирует, имеют дефицит электронов и, следовательно, являются электрофильными реагентами или кислотами. Точно так же как типичными реакциями алкенов являются реакции электрофильного присоединения, типичными реакциями бензольного кольца будут реакции электрофильного замещения. Как известно, для ароматических углеводородов наиболее характерными являются реакции замещения, которые протекают легче, чем у предельных углеводородов. Особенностью этих реакций является то, что после их завершения полностью сохраняется ароматичность исходных веществ (субстрата). Галогенирование В зависимости от условий проведения реакции галогенирования могут получаться галогенопроизводные с атомом галогена в ядре или боковой цепи:

Различают моно-, ди-, три- и полигалогенопроизводные. Если реакцию проводить на холоду в присутствии катализаторов (FeCl3, FeBr3, AlCl3, SbCl3, SbCl5, I2), то образуются производные с галогеном в ароматическом ядре. Роль катализатора заключается в поляризации молекулы галогена с образованием положительно заряженного иона (галогенирующего агента), который затем атакует бензольное ядро по схеме:Cl2 + FeCl3⇄Cl+ + FeCl4-, в присутствии йода – по схеме Cl2 + I2 ⇄ 2Cl I; Cl I⇄ Cl-+ I+; I+ + Cl2 ⇄ ClI + Cl+. Реакция галогенирования идет по механизму, рассмотренному выше:

Чтобы ввести атом галогена в боковую цепь, реакцию проводят при нагревании или на свету без катализаторов. Реакция носит радикальный характер:

При дальнейшем хлорировании образуется хлористый бензилиден С6Н5СНС12 и бензотрихлорид С6Н5—СС13. При введении в ядро бензола йода необходимо присутствие окислителей, которые окисляют образующуюся йодистоводородную кислоту и тем препятствуют ее восстанавливающему действию, а возможно окисляют и йод до йодноватистой кислоты, которая, видимо, более энергично действует на бензол. Реакция йодирования аренов (метод Тронова-Новикова) возможно в присутствии таких окислителей, как H2O2, HNO3, ICl, HIO3 и др. Окислители превращают йод в катион I+, который и является действующим электрофильным реагентом:

Нитрование Нитрогруппа в ароматических нитросоединениях может быть связана с бензольным ядром или находиться в боковой цепи:

Различают моно-, ди- и тринитропроизводные ароматических углеводородов. Ароматические нитросоединения с нитрогруппой в ядре получают нитрованием ароматических углеводородов нитрующей смесью–смесью концентрированных азотной и серной кислот (при температурах, не превышающих 40–50 °С). При взаимодействии этих кислот образуется смесь ионов, из которых нитрующим агентом является ион нитрония NO2+; HNO3 + 2H2SO4⇄NO2+ + H3O++ 2HSO4-.Ион нитрония атакует бензольное кольцо:

H+ + HSO4- → H2SO4. Находящаяся в бензольном кольце нитрогруппа уменьшает скорость дальнейшего нитрования. Однако в жестких условиях можно ввести вторую (при 90 °С) и даже третью (при 100–110 °С) нитрогруппы, которые располагаются в м-положениях относительно друг друга:

В то же время толуол нитруется во много раз легче, чем свободный бензол. Это объясняется +I-эффектом метильной группы (создается избыток электронной плотности в кольце):

При нитровании гомологов бензола, содержащих два заместителя, сказывается стерический эффект. Если, например, эти заместители находятся в положении, нитрогруппа становится рядом с меньшим заместителем:
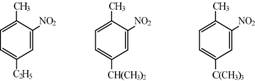
Нитросоединения с нитрогруппой в боковой цепи получают теми же методами, что и нитросоединения алифатического ряда (реакция Коновалова):

Реакция носит радикальный характер. Одним из способов получения нитросоединений с нитрогруппой в боковой цепи является реакция галогенопроизводных (с галогеном в боковой цепи) с нитритом серебра:

Сульфирование Сульфогруппа в ароматических сульфопроизводных может находиться в бензольном кольце или боковой цепи:

В молекуле ароматического сульфопроизводного может быть одна, две и три сульфогруппы. Cульфокислоты получают прямым сульфированием углеводородов или их производных. Монобензолсульфокислота получается при действии на бензол концентрированной серной кислоты на холоду: С6H6 + HO– SO2OH ⇄ С6H5 – SO2OH + H2O. Сульфирование проходит по обычному механизму электрофильного замещения. Активным электрофильным агентом является, прежде всего, бисульфониевый ион, образующийся в результате протекания реакции 3H2SO4 ⇄ SO3H+ + H3O+ + 2HSO4-,

Еще более активным электрофильным агентом является оксид серы (VI), в молекуле которого электронная плотность распределена таким образом, что атом серы несет положительный заряд:

Являясь сильным электрофилом, атом серы атакует π-электронную систему ароматического кольца:

Триоксид серы более реакционноспособен, чем серная кислота, и может быть использован в стехиометрических количествах. Продукты реакции не содержат избытка серной кислоты. Гомологи бензола сульфируются в орто- и пара-положение. Алкилирование – введение алкильной группы в молекулу органического соединения (например, в бензольное кольцо). При алкилировании и ацилировании ароматических углеводородов получают соответственно их алкильные и ацильные производные. Реакции алкилирования и ацилирования относятся к реакциям электрофильного замещения и называются реакциями Фриделя–Крафтса. Реакцию алкилирования проводят при действии на вещество галогеналкилов в присутствии катализатора–безводного AlCl3. Роль катализатора заключается в образовании положительно заряженного карбкатиона, который электрофильно атакует бензольное кольцо: CH3Cl + AlCl3⇄+CH3[AlCl4]-,

Вместо галогеналкилов в качестве алкилирующих средств применяют также непредельные углеводороды и спирты. В этом случае в качестве катализатора используют минеральные кислоты. Роль последних состоит в превращении алкенов и спиртов в соответствующие карбкатионы: CH2=CH2+H+⇄+CH3—CH2, CH3OH+ H+⇄CH3OH2+⇄CH3++H2O. Таким способом получают, например, этилбензол и изопропилбензол (кумол):

Реакции присоединения Эти реакции не характерны для бензола, поэтому они протекают с большим трудом. Только в особых условиях (высокая температура, облучение ультрафиолетовым светом, катализатор) бензол проявляет слабо выраженный непредельный характер и может присоединять водород и галогены.
Например, в присутствии катализатора (платина, никель или палладий) бензол вступает в реакцию гидрирования с образованием циклогексана:

При облучении УФ-светом к бензолу могут присоединиться шесть атомов хлора. В результате образуется гексахлорциклогексан (гексахлоран):

Циклопропенилий-катион I (2π-электронная система), циклопентадиенил-анион II (6π-электронная система),циклогептатриенил-катион III(6π-электронная система),циклооктатетраенил-дианион IV (10π-электронная система):

Ниже приведена схема с указанием молекулярных р-орбиталей циклопропенил-катионаи циклопентадиенил-аниона. Стрелками показаны π-электроны ароматической системы:

Небензоидные ароматические соединения обладают заметной устойчивостью, которая обусловлена их ароматическими свойствами. Все примеры небензоидных ароматических соединений были синтезированы, и таким образом была доказана их ароматичность. Азуле́н С10Н8—бициклодекапентаен—небензоидное ароматическое соединение, содержащее конденсированную систему из 5- и 7-членного циклов. Является изомером нафталина. Молекула обладает дипольным моментом. Вследствие высокой электронной плотности на 5-членном цикле, азулен обладает относительно высокой химической активностью, легковступая в реакции с
электрофильными агентами. Производные азулена достаточно широко встречаются в природных эфирных маслах. Кристаллическое вещество синего или сине-фиолетовогоцвета. Нерастворим в воде, растворим в углеводородах, диэтиловом эфире, этаноле. Перегоняется с паром. Хорошо растворяется в серной и фосфорной кислоте собразованием солей (при этом его синяя окраска исчезает). Легко образует π-комплексы с пикриновой кислотой и тринитробензолом. Химические свойства При нагревании свыше 300 °C изомеризуется в нафталин. Постепенно окисляется кислородом воздуха, а придействии KMnO4 в кислой среде расщепляется до смеси жидких и газообразных продуктов. В реакциях электрофильного и радикального замещения ведет себя подобно высокоактивным пятичленным гетероциклам. Относительно легко нитруется тетранитрометаном в среде пиридина:

В реакциях галогенирования, ацилирования, азосочетания и др. замещение идет в положение 1 и затем 3:

В реакциях с нуклеофилами азулен менее активен, замещение идет в положение 4, 8 и далее в 6. Получение Из солей пиридиния. Применение Азулен и, особенно, его природные производные достаточно широко используются в парфюмерии и косметике: входят в состав зубных паст, кремов, шампуней и других средств ухода за телом. Физиологическая роль Азулены обладают противовоспалительной, антиаллергенной и бактериостатической активностью, на чем и основано их применение.
|
Просмотров 3623 |
|
|
