
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

По атомности по основности по взаимному расположению
|
|
Конкретные задачи
1. Студент должен знать: формулы важнейших представителей гидроксиальдегидов и гидроксикетонов; гидрокси – и оксокислот; их структуру, названия, нахождение в природе, биологическую роль, классификацию, общие и специфические химические свойства; иметь представление о стереоизомерии: энантиомерии и диастереомерии, оптической активности, относительной и абсолютной конфигурации, рацематах и способах их разделения.
2. Студент должен уметь: писать уравнения реакций, отражающие химические свойства гетерофункциональных соединений; правильно выбрать участвующую в реакции функциональную группу в зависимости от реагента и условий проведения реакции; писать таутомерные формы эфиров ацетоуксусной и щавелевоуксусной кислот и реакции, подтверждающие наличие различных таутомерных форм; определять хиральность молекул, количество стереоизомеров, писать их формулы, определять относительную конфигурацию (D или L); находить оксикислотный ключ, определять энантиомеры и диастереомеры, мезоформу.
Проделывать реакции по доказательству строения винной кислоты: двухосновности и многоатомности; по доказательству способности молочной кислоты к окислению и переходу в пировиноградную кислоту с идентификацией последней с помощью цветной реакции на кетогруппу с нитропруссидом натрия; по доказательству существования кетонной и енольной формы ацетоуксусного эфира.
Мотивация. Гидрокси – и оксосоединения являются биологически важными веществами, участниками биохимических процессов. Например, яблочная и лимонная кислоты участвуют в ЦТК Кребса, пировиноградная кислота – узловой промежуточный продукт при обмене веществ, a - кетоглутаровая кислота является предшественником важной аминокислоты – глутаминовой и т.д. Ряд из них являются лекарственными препаратами. Например, соли молочной (лактаты), лимонной (цитраты) и яблочной (малаты) кислот с железом применяются при малокровии, соли лимонной кислоты – при консервировании донорской крови.
Вопросы для самоподготовки
1. Общие свойства карбоновых кислот, спиртов, альдегидов и кетонов.
2. Специфические свойства гидроксикислот:
а) отношение к нагреванию a-, b-, g-, d- гидроксикислот;
б) разложение a- гидроксикислот при нагревании в присутствии серной кислоты;
3. Специфические свойства оксокислот:
а) кето-енольная таутомерия b-оксокислот;
б) разложение при нагревании – декарбоксилирование.
4. Виды стереоизомерии. Определение стереоизомеров: энантиомеров и
диастереомеров.
5. Оптическая активность. Условия проявления оптической активности –
хиральный центр и хиральность молекулы.
6. Проекционные формулы Фишера стереоизомеров молочной и винной кислот.
7. Абсолютная и относительная конфигурация стереоизомеров. Оксикислотный
ключ. Ключевые соединения: D– и L- глицериновый альдегид. Рацематы.
Способы их разделения.
Этапы занятия и контроль усвоения знаний
Продолжительность занятия – 4 часа.
| Этапы занятия | Формы проведения | Время |
| 1. Контроль выполнения домашнего задания. | Проверка преподавателем выполнения домашнего задания в рабочих тетрадях. | 15 мин. |
| 2. Контроль самоподготовки. | Написание тест – контроля и его оценка. | 15 мин |
| 3. Разбор теоретического материала. | Опрос студентов у доски, объяснение преподавателем наиболее трудных и важных вопросов, демонстрация моделей, плакатов. | 90 мин |
| 4. Приобретение практических навыков. | Выполнение лабораторных работ по теме занятия. | 30 мин |
| 5. Оформление протоколов лабораторных работ. | Заполнение графы «Визуальные наблюдения» в протоколах лабораторных работ. Самостоятельный анализ полученных данных и формулировка выводов. | 15 мин |
| 6. Проверка и защита протоколов. | Собеседование и оценка практических навыков преподавателем. | 15 мин |
Содержание этапов занятия
1-й этап. Преподаватель проверяет и оценивает по пятибалльной системе выполнение домашнего задания по заданной теме и отвечает на вопросы студентов.
2-й этап. Студенты письменно отвечают на билет тест – контроля. Ответ оценивается по десятибалльной системе (0, 5, 10 баллов).
3-й этап. При обсуждении теоретического материала необходимо вспомнить свойства карбоновых кислот, спиртов, альдегидов и кетонов как соединений, определяющих общие химические свойства гидрокси- и оксокислот. Разобрать специфические свойства: отношение к нагреванию a-, b-, g-гидроксикислот на примере молочной,
b-гидроксимасляной, g-гидроксимасляной кислот; способность a- гидроксикислот разлагаться при нагревании в присутствии серной кислоты на примере молочной кислоты; реакции декарбоксилирования пировиноградной и ацетоуксусной кислот; кето-енольную таутомерию на примере ацетоуксусного эфира; оптическую изомерию на примере винной и молочной кислот.
4-й этап. Студенты по 2 человека выполняют лабораторные работы по теме занятия.
5-й этап. Студенты оформляют в рабочей тетради протокол лабораторной работы в виде таблицы. Заполняют графы «Наблюдения и выводы»
6-й этап. Студенты предоставляют оформленный протокол и объясняют полученные результаты. Преподаватель оценивает приобретенные практические навыки.
Теория
Органические соединения, содержащие ОН- и >С=О группы, называются гидроксиальдегидами и гидроксикетонами. Важнейшие представители приведены в таблице 1.
Соединения, содержащие -ОН и -СООН группы, называются гидроксикислотами (таблица 2).
Гидроксикислоты
Классификация
 Гидроксикислоты
Гидроксикислоты
 | |||
 | |||
по атомности по основности по взаимному расположению
Двух функциональных групп
| по количеству -ОН групп, включая и входящую в -СООН, бывают двух- и многоатомными | по количеству -СООН групп бывают одно- и многоосновными | бывают a-,.b-, g- и т.д. гидроксикислотами |
Виды изомерии: структурная – по положению 2-й функциональной ОН – группы относительно – СООН; стереоизомерия (энантиомерия, диастереомерия)
Химические свойства
I Гидроксикислоты проявляют общие свойства спиртов и кислот. В зависимости от реагентов и условий проведения реакций взаимодействует ОН или -СООН группа или обе одновременно. Как кислоты они более сильны, чем соответствующие карбоновые кислоты (сказывается –I эффект ОН- группы).
П. Гидроксикислоты проявляют специфические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.
1. Например, своеобразная реакция отщепления воды при нагревании.
Она позволяет отличить a-, b-, g- и другие гидроксикислоты.

 а)
а)
a t°


гидролиз + 2H2O
+ H+ или OH-

a лактиды
(циклические

 сложные эфиры)
сложные эфиры)
б) b a t°

-H2O
b -оксимасляная кротоновая кислота
кислота
 в) b a t°
в) b a t°


 + H2O
+ H2O
гидролиз
g H+
g-гидроксимасляная g - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)

 b a
b a
t°

 g + H2O
g + H2O
гидролиз
H+
d
d-гидроксивалериановая d - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение a-гидроксикислот при нагревании в присутствии H2SO4:
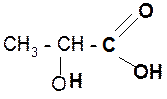 |
a t°, H2SO4
 CH3–CHO + HCOOH
CH3–CHO + HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как b-гидроксикислоты:
 | |||
 | |||
t°


-Н2О
 лимонная кислота цис-аконитовая к-та
лимонная кислота цис-аконитовая к-та
+ Н2О

против правила
Марковникова
изолимонная кислота
б) при действии H2SO4 и нагревании она ведет себя как a-гидроксикислота, т.е. разлагается с выделением муравьиной кислоты:


 t°, H2SO4
t°, H2SO4
 +
+
ацетондикарбоновая




 кислота
кислота
 2СO2 +
2СO2 +
Таблица 1
Гидрокси – и оксоальдегиды и кетоны
| Формула | Тривиальное название | ИЮПАК – номенклатура | Местонахождение в природе и биологическая роль |
 
| Гликолевый, или гидроксиуксусный альдегид | 2– гидроксиэтаналь | Предшественник гликолевой кислоты |
| Глицериновый альдегид | 2,3–дигидрокси-пропаналь | Стандарт конфигурации всех «хиральных» соединений: гидрокси- и аминокислот, углеводов и др. | |

| Дигидроксиацетон | 1,3 – дигидрокси-2-пропанон | В виде фосфорно-кислого эфира встречается как промежуточный продукт при окислении глюкозы в организме |

 Продолжение таблицы 2
Продолжение таблицы 2
| Формула | Тривиальное Название кислот (их солей и эфиров) | ИЮПАК-номенклатура | Атомность | Основность | Местонахождение в природе и биологическая роль |

| Винная (виноградная), или a,b-дигидрокси янтарная кислота (тартраты) | 2,3-дигидрокси бутандиовая кислота | 4-х атомная | 2х основная | Содержится в виноградном соке. Является продуктом жизнедеятельности бактерий. Применяется как консервант в пищевой промышленности, в красильном деле. Соли (тартраты) применяются в радиотехнике (пьезокристаллы) и в биохимическом анализе в виде Фелинговой жидкости для обнаружения альдегидов. Существует в трех стереоизомерных формах (L-, D- и мезо-) |

| Лимонная , или b-гидрокси-b-карбокси-глутаровая (цитраты) | 3-гидрокси-3-карбоксипентан диовая | 4-х атомная | 3-х основная | Содержится в лимонах, апельсинах, винограде, в листьях махорки. Играет важную роль в ЦТК. Соли (цитраты) применяются для консервирования донорской крови, соли железа – при малокровии. |
Оксокислоты
Наиболее важные природные оксокислоты представлены в Таблице 3
Химические свойства
I. Они проявляют общие свойства, присущие альдегидам или кетонам и кислотам, но как кислоты они сильнее соответствующих карбоновых кислот (сказывается –I эффект карбонильной группы)
П Специфические свойства, обусловленные взаимным влиянием
>C=O и -COOH групп:
1. Расщепление a- и b- оксокислот при нагревании – декарбоксилирование:
 dˉ
dˉ
 d+ d+ t°, H2SO4разб.
d+ d+ t°, H2SO4разб.
 а) + CO2
а) + CO2
dˉ
 b t° комн.
b t° комн.

 б) + CO2
б) + CO2
 2. Кето-енольная таутомерия b-оксокислот.
2. Кето-енольная таутомерия b-оксокислот.
 d+ a
d+ a


:
–d
кето-форма енольная форма
ацетоуксусная кислота (АУК)
Обе формы известны в свободном состоянии и могут быть при определенных условиях выделены. Однако они обе неустойчивы – легко превращаются в равновесную смесь с содержанием кето-формы (93%) и енольной (17%). Стойкость енола по сравнению с другими енольными формами возрастает из-за сопряжения.
Для доказательства существования обеих форм пользуются соответствующими реакциями. Например, как кетон АУК восстанавливается до вторичного спирта, реагирует с HCN, фенилгидразином и т.д. Как енол АУК или ее этиловый эфир (ацетоуксусный эфир) дает окрашивание при действии разбавленного водного раствора FeCl3 вследствие образования комплексной железной соли (хелата):
 |
Таблица 3
Оксокислоты
| Формула | Тривиальное название кислот (их солей и эфиров) | ИЮПАК-номенклатура | Местонахождение в природе и биологическая роль |

| Глиоксиловая, или формилму-равьиная (глиоксилаты) | 2-оксо-этановая | Это единственная a-альдегидо-кислота. Встречается в недозревших фруктах. |

| Пировиноград-ная, ацетилму-равьиная (пируваты). | 2-оксо-пропановая | Ключевой промежуточный продукт при обмене веществ в организме |

| Ацетоуксусная, b-оксомасляная (ацетоацетаты) | 3-оксобу-тановая | Образуется в процессе метаболизма высших жирных кислот и как продукт окисления b-оксимасляной кислоты, накапливается при сахарном диабете. |

| Щавелевоуксус-ная, ЩУК (оксалоацетаты) | 2-оксобу-тандиовая | Образуется в ЦТК |

| a-кетоглутаровая (a-кетоглутара-ты) | 2-оксопен-тандиовая | Образуется в ЦТК и является предшественником важнейших аминокислот: глутаминовой и g-амино-масляной (ГАМК) |
Стереоизомерия
Стереоизомеры отличаются друг от друга пространственным расположением атомов или групп атомов.
Стереоизомеры
 | |||
 | |||
Энантиомеры Диастереомеры
(оптические,
или зеркальные,
изомеры)
Знание стереоизомерии очень важно для изучения строения природных соединений (биорегуляторов и лекарственных средств – гормонов, витаминов, антибиотиков), так как все они существуют в строго определенных пространственных формах и их биологическая активность тесно связана с пространственным строением.
Так, для построения белковой молекулы используется один вид энантиомеров – L– аминокислоты, а в классе углеводов большее распространение имеют D–сахара. Из двух энантиомерных форм гормона адреналина большей фармакологической активностью обладает D(-)–форма. Стереоспецифично протекают многие биохимические реакции, так как они катализируются ферментами – белковыми молекулами.
Приведем некоторые примеры значения диастереомерии.
Бутендиовая кислота существует в виде двух геометрических изомеров (цис- и транс-), но только один из них – фумаровая кислота (транс–изомер) – служит субстратом для действия фермента.
Ретинол с транс–расположением всех двойных связей более эффективен в процессах зрения, чем его цис–изомер.
В липиды клеточных мембран в качестве структурных составляющих входят также только цис-формы высших жирных кислот.
Энантиомерия осуществляется у так называемых «хиральных» молекул. Хиральными, или асимметрическими, молекулами называются те, которые не могут быть совмещены со своим зеркальным отражением; у них отсутствует плоскость симметрии:
 |



 |
Термин «хиральность» произошел от греческого слова «хиро» – рука.
Самым простым наглядным примером хиральных объектов являются правая и левая руки.
Атом углерод с четырьмя различными группами называется асимметрическим, или хиральным, центром.
Для изображения энантиомеров на плоскости используются проекционные формулы Фишера, называемые проекциями Фишера:
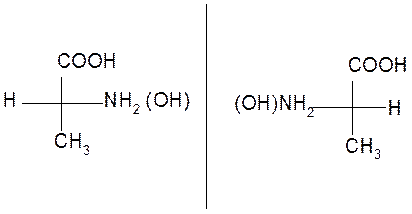 |
Энантиомеры
Относительная и абсолютная конфигурация. Определение абсолютной конфигурации стало возможным только с появлением современных физико-химических методов (рентгеноструктурного анализа) в 50-х годах. Однако нет необходимости устанавливать ее для каждого соединения. Можно охарактеризовать их путем сравнения конфигураций с абсолютной конфигурацией эталонных (ключевых) соединений, т. е. определить их относительную конфигурацию.
За такой эталон условно принят глицериновый альдегид, предложенный в 1906 г. Н.А. Розановым:
 | |||
 | |||

D- глицериновый L-глицериновый
альдегид альдегид
Считается, что все вещества, родственные глицериновому альдегиду по конфигурации хирального центра, т.е. с расположением групп – ОН, -NH2 , - Hal справа, относятся к D–ряду, слева – к L– ряду.
Например:


D - аминокислота L – аминокислота
Запомним, что D и L указывают на относительную конфигурацию молекулы. Познакомимся с некоторыми свойствами подобных молекул.
Хиральным соединениям свойственна способность вращать плоскость поляризованного света вправо (+) или влево (-), что называется оптической активностью. Отсюда и другое название энантиомеров – оптические изомеры.
Условиями оптической активности являются:
- Отсутствие плоскости симметрии (хиральность молекулы)
- Наличие в молекуле центров хиральности.
Мерой оптической активности является [a]D - удельное вращения; характеризует угол и направление вращения плоскости поляризованного света. Знак вращения (+) или (-) не связан с конфигурацией D и L и определяется только инструментально на приборе – поляриметре или сахариметре (для сахаров). Например,
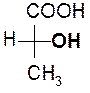

D(-) –молочная D(+)- глицериновый
кислота альдегид
Многие биологически важные вещества содержат в молекуле более одного центра хиральности. Подсчет числа стереоизомеров производится по формуле N= 2n, где n – число хиральных центров.
Представителем соединений с двумя центрами хиральности служит винная кислота. Рассмотрим этот пример подробнее.
У винной кислоты n=2, т.е. N= 22 = 4.
 |  |  |  | ||||
1 2 3 4
1. D–винная кислота; 2. L-винная кислота; 3 и 4 – мезовинная кислота
1 и 2 – это энантиомеры (D и L). Они отличаются не по физическим и химическим свойствам, а только знаком вращения плоскости поляризованного света. Формулы 3 и 4 являются идентичными. Формулы 1 и 3, 2 и 3 являются пространственными изомерами, но не зеркальными, это диастереомеры. Они отличаются по физическим и химическим свойствам.
При отнесении энантиомеров к D– или L-ряду пользуются «оксикислотным ключом», т.е. сравнивают со стандартом тот хиральный центр, который остался без изменения при переходе от него. В данном случае это верхний хиральный центр (приведите путь превращения глицеринового альдегида в винную кислоту).
D– и L- энантиомеры проявляют оптическую активность. Мезовинная кислота – типичный пример молекулы, содержащей центры хиральности, но в целом являющейся ахиральной из-за наличия плоскости симметрии и потому не проявляющей оптическую активность.
Рацемат– это смесь равных количеств энантиомеров. Оптической активностью не обладает, вследствие компенсации вращения. Таким образом, у винной кислоты существуют 4 формы: 2 энантиомера (D- и L-), 1 мезо-форма и 1 рацемическая смесь. Рацемические смеси получаются синтетическим путем.
Поскольку природные источники не могут удовлетворить потребности современной биоорганической и биологической химии в разнообразных оптически активных соединениях, то либо расщепляют рацематы, либо ведут асимметрический синтез.
Существует несколько способов расщепления рацематов:
а) механический отбор кристаллов по их форме – исторически первый метод, примененный Луи Пастером;
б) биохимический (ферментативный) метод;
в) химический – через диастереомеры;
г) хроматографический на оптически активных сорбентах.
Глоссарий
Лактон– внутренний циклический сложный эфир, образующийся при нагревании g- и d-гидроксикислот .
Лактид – циклический сложный диэфир, образующийся при нагревании
a- гидроксикислот; имеет две сложноэфирные связи.
Ацетоуксусный эфир – этиловый эфир ацетоуксусной кислоты.
Таутомерия – явление существования в растворе равновесных изомерных форм, способных переходить в друг в друга; равновесная динамическая изомерия.
Кето-енольная таутомерия – равновесие между кетонной и енольной формами
Стереоизомеры – это изомеры, отличающиеся пространственным расположением атомов в молекуле.
Плоскость симметрии – это воображаемая плоскость, проходящая через молекулу или атом углерода с его заместителями и делящая молекулу на две симметричные части.
Оптическая активность – способность вещества вращать плоскость поляризованного света вправо или влево.
Хиральность – отсутствие плоскости симметрии, несовместимость со своим зеркальным изображением.
Энантиомеры – это стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
Диастереомеры – стереоизомеры, не являющиеся зеркальным отражением друг друга, обладающие различными физико-химическими свойствами.
Рацемическая смесь (рацемат) – эквимолярная смесь энантиомеров (1:1)
|
Просмотров 1501 |
|
|
