
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

III. Биологически важные реакции a- аминокислот
|
|
1. Способность к образованию внутренних солей (биполярных, или «цвиттер» – ионов). Карбоксильная группа проявляет кислотные свойства, диссоциирует с отщеплением протона. Амино-группа, которая проявляет основные свойства, способна протонироваться по неподеленной электронной паре атома азота. В результате в водных растворах и в кристаллическом состоянии аминокислоты существуют в виде внутренних солей:



 +
+
NH2-CH-COOH NH3-CH-COO-
½ ® ½
R R
Суммарный заряд молекулы зависит от строения радикала R и рН среды:
а) моноаминомонокарбоновая кислота:
OH- + H+ +
[NH2-CH2-COO-] -1 ® [NH3-CH2-COO -]0 ®[ NH3-CH2-COOH]+1
б) моноаминодикарбоновая кислота:





 + +
+ +
NH2-CH-COO- -2 NH3-CH-COO- -1 NH3-CH-COO- °
½ HO- ½ Н+ ½
CH2 ® CH2 ® CH2
½ ½ ½
COO- COO- COOН


2Н+

 +
+
NH3-CH-COOH +1
½
CH2
½
СOOH
в) диаминомонокарбоновая кислота:
 | |||||||||||
 |  |  |  | ||||||||
 | |||||||||||
NH2-CH-COO- ° + NH3-CH-COO- +1 + NH3-CH-COOH +2
½ HO- ½ Н+ ½
(CH2 )4 ® ( CH2 )4 ® (CH2)4 - ½ ½ ½
+ NH3 +NH3 +NH3
¯2НО-


NH2-CH-COO- -1
½
(CH2)4
½
NH2
Свойство аминокислот изменять заряд при определенном значении рН, а следовательно, двигаться в электрическом поле к разным электродам лежит в основе метода электрофореза, который используется для разделения смесей аминокислот и белков.
Значение рН среды, при котором суммарный заряд молекулы равен нулю, называется изоэлектрической точкой (ИЭТ, или рНi , или pI). В ИЭТ молекула теряет электрофоретическую подвижность, снижается растворимость белка в воде, он может выпадать в осадок.
2. Реакция декарбоксилирования:

 in vivo
in vivo


декарбоксилаза
CO2 +
 in vitro
in vitro
 |
t°, Ba(OH)2
гистидин гистамин


 СО2 +
СО2 +
триптофан триптамин
В результате реакции декарбоксилирования a- аминокислот образуются биогенные амины, обладающие сильной физиологической активностью, многие из них являются аллергенами, большинство обладает сосудосуживающими свойствами (исключение – гистамин), участвуют в регуляции жизненно важных функций организма.
3. Реакции дезаминирования:
а) дезаминирование по Ван-Слайку in vitro:
 NH2-CH2-COOH + HONO N2 + HO-CH2-COOH + H2O
NH2-CH2-COOH + HONO N2 + HO-CH2-COOH + H2O
глицин гликолевая кислота
По объему выделяющегося газообразного азота судят о количестве аминокислоты в растворе.
б) неокислительное дезаминирование in vivo протекает у низших организмов (бактерий, грибов):
-NH3
 HOOCCH-CH2®COOH HOOC –CH=CH-COOH
HOOCCH-CH2®COOH HOOC –CH=CH-COOH
¯ фумаровая кислота
NH2
аспарагиновая кислота
в) окислительное дезаминирование in vivo:
фермент, НАД+



 HOOC – (CH2)2 – CH _ COOH HOOC-(CH2)2-C-COOH
HOOC – (CH2)2 – CH _ COOH HOOC-(CH2)2-C-COOH
½ -НАД.H;-H+
NH2NH
глутаминовая кислота
H2O
 HOOC-(CH2)2-C-COOH
HOOC-(CH2)2-C-COOH

 -NH3
-NH3
O
a- кетоглутаровая кислота
Реакция протекает под действием фермента глутаматдегидрогеназы и кофермента
НАД+.
4. Реакция трансаминирования (переаминирования) in vivo:
фермент трансфераза

 NH2-CH-COOH +
NH2-CH-COOH +
½ пиридоксальфосфат
CH3 (вит. В6)
аланин a- кетоглутаровая
кислота
 О=С-СOOH + НООС-СH-(СH2)2-СOOH
О=С-СOOH + НООС-СH-(СH2)2-СOOH
½ ½
CH3 NH2
пировиноградная глутаминовая
кислота кислота
 5. Способность к образованию полипептидов. Карбоксильная группа одной аминокислоты может реагировать с аминогруппой другой аминокислоты с образованием пептидной связи:
5. Способность к образованию полипептидов. Карбоксильная группа одной аминокислоты может реагировать с аминогруппой другой аминокислоты с образованием пептидной связи:
-H2O
 NH2-CH-C=O + H-NH-CH-C=O
NH2-CH-C=O + H-NH-CH-C=O
½ ½ ½ ½
R 1 OHR2 OH
Дипептид
Последовательность аминокислот, соединенных между собой пептидными связями, является первичной структурой белков.
Процесс, обратный образованию пептида, называется гидролизом. Существуют три вида гидролиза белка: кислотный, щелочной и ферментативный. Результатом является образование смеси аминокислот, которые могут быть разделены и идентифицированы методами хроматографии или электрофореза.
Таким образом определяют аминокислотный состав белка.
Рассмотрим пример: Составить трипептид Глу-Асн-Про и дать ему полную
характеристику.

 -2H2O
-2H2O

 + +
+ +
 |
 | |||
 | |||
глутамил-аспарагинил-пролин
В названии пептида окончания аминокислот меняются на «ил», кроме последней аминокислоты.
Характеристика пептида. 1. Реакция пептида на индикатор – кислотная, так как в пептиде две кислотные группы – СOOH и одна основная –NH2
(группа – С=О не проявляет основных свойств – см. классификацию)
½
NH2
2. Суммарный заряд пептида в водной среде:


 -1
-1
+

 3. Изменение суммарного заряда с изменением рН среды. Запишем пептид в упрощенном виде, выделив лишь заряженные группы и обозначив остальную часть пептида радикалом R: +
3. Изменение суммарного заряда с изменением рН среды. Запишем пептид в упрощенном виде, выделив лишь заряженные группы и обозначив остальную часть пептида радикалом R: +

 0 +1
0 +1 

 -1 H+ + H+
-1 H+ + H+ 


 +
+
 OH-
OH-
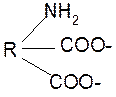

 -2
-2
4. Изоэлектрическая точка пептида (определение см. выше) лежит в слабокислой
среде.
5. Поверхностные свойства пептида зависят от соотношения гидрофильных и
гидрофобных боковых радикалов и концевых групп.
В пептиде содержатся 4 гидрофильные группы: 2-СOOH, -C=O, +NH3
и одна гидрофобная: радикал пролина ½
NH2
Гидрофильных групп больше, поэтому поверхность пептида гидрофильна, он растворим в воде.
Пептиды являются продуктом частичного гидролиза белков. Но многие пептиды присутствуют в свободном состоянии в клетках и тканях и выполняют специфические биологические функции. К ним относятся гормоны, антибиотики и другие соединения, обладающие высокой биологической активностью.
Самостоятельное значение пептидов в процессах жизнедеятельности человеческого организма велико. В нервной ткани выделены нейропептиды, влияющие на функции нервной системы: энкефалины, эндорфины – «опиоидные» пептиды, аналогично морфину подавляющие боль; пептиды, действующие на сон; пептиды памяти и др.
Известны гормоны пептидной природы: окситоцин, вазопрессин (гормоны задней доли гипофиза), меланоцитстимулирующий гормон (выделяется средней долей гипофиза), адренокортикотропный гормон (АКТГ) (передней доли гипофиза), глюкагон (поджелудочной железы), гормоны желудочно-кишечного тракта и др.
К пептидам относятся токсины, выделенные из бледной поганки, токсины яда пчел, змей, скорпионов, морских позвоночных.
В медицине используются пептиды-антибиотики: грамицидин S, актиномицин и др.; пептиды-регуляторы иммунитета: тафцин; пептиды – заменители сахара: аспартам и т.д.
Строение пептидной связи


 ..
..
¾ ¾ N ¾
½
H
 Атом углерода пептидной связи находится в sp2 –гибридизации. Неподеленная электронная пара атома азота вступает в сопряжение с p- связью . Таким образом, пептидная связь представляет собой трехцентровую r,p- сопряженную систему.
Атом углерода пептидной связи находится в sp2 –гибридизации. Неподеленная электронная пара атома азота вступает в сопряжение с p- связью . Таким образом, пептидная связь представляет собой трехцентровую r,p- сопряженную систему.

В результате связь C-N приобретает характер двоесвязанности, становится «полуторной». Вращение вокруг этой связи затруднено. В большинстве природных белков и пептидов имеет место транс-конфигурация пептидной связи, что важно для стабилизации вторичной структуры.
 Для пептидной связи характерно явление лактам-лактимной таутомерии:
Для пептидной связи характерно явление лактам-лактимной таутомерии:

 OH
OH
½

 N ¾ ¾ C = N ¾
N ¾ ¾ C = N ¾
½
H
лактам лактим
За счет лактимной формы пептиды дают качественную цветную реакцию с ионами Сu2+ аналогично биурету – веществу, получаемому из 2 молекул мочевины:



 +
+
-NH3
мочевина биурет



 |
лактамная форма биурета лактимная форма биурета
 |
Эта реакция называется биуретовой. Она используется как качественная реакция для обнаружения пептидов и белков.
|
Просмотров 986 |
|
|
