
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Принцип Паули. Периодическая система
|
|
Внешнее магнитное поле влияет на деление электронов в атоме, приводя к расщеплению спектра. Вектор орбитального момента импульса может принимать только такие ориентации в пространстве, при которых проекция вектора на Oz, совпадающая с направлением H, может принимать значения, которые определяются m (магнитное квантовое число).

Графическая иллюстрация.
Переходя к энергии атома, можно говорить, что каждому разрешенному значению энергии соответствует несколько волновых функций, определяемых этими квантовыми числами (n, l, m).
 - пси-функции определяются значениями l и m. Это означает, что атом может иметь не одно, а несколько одинаковых значений энергии, находясь в разных состояниях.
- пси-функции определяются значениями l и m. Это означает, что атом может иметь не одно, а несколько одинаковых значений энергии, находясь в разных состояниях.
Такие состояния (с одинаковой энергией) – вырожденные.
Возможное число состояний – кратность вырождения данного энергетического уровня.
При известных границах изменений l (0,1) и m (-l, l) красность вырождения определяется: 
Пример. 





При рассмотрении тонкой структуры атомов вводится понятие магнитное спиновое квантовое число.
 Отсюда, квантосто вырождения увеличивается в 2 раза:
Отсюда, квантосто вырождения увеличивается в 2 раза: 
Такое значение Кв согласуется с принципом запрета Паули. Согласно нему, в любом атоме не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чисел. В соответствии с ним и определяется распределение электронов.

Оболочка – совокупность электронов.
Слой – совокупность оболочек с одинаковым n.
Приницпы построения: 1. Порядковый номер равен общему числу электронов в атоме.
2. Состояние электронов в атоме определяется набором 4 квантовых чисел.
3. Распределение энергии по уровням должно удовлетворять приницпу минимума потенциальной энергии.
4. Заполнение электронных энергетических уровней в атоме должно происходить в соответствии с принципом Паули.
Молекулы и их спектры.
Существуют 2 вида межатомной связи: ковалентная и ионная. Оговоримся, что будем рассматривать простейшие 2-атомные молекулы.
Ковалентная. Образуется в молекулах, где часть электронов одновременно двигается около 2 ядер.
Образуется парами электронов с противоположно-направленными спинами.
При этом в молекулах с одинаковыми ядрами (кислород, азот и пр.) электроны распределяются симметрично, в других же – наблюдается некая ассиметрия. Благодаря этому молекулы обладают дипольным моментом.
Ионная. Образуется, когда электроны можно разделить на 2 группы: по отношению к 2 ядрам.
При этом они распределяются неравномерно, что приводит к избытку/недостатку у одного/второго ядра. => Образование положительного и отрицательного ионов. Они подчиняются электростатическому взаимодействию (закон Кулона).
Рассмотрим простейшую молекулу водорода (2 протона и 2 электрона). Отметим, что получающиеся значения энергии оказываются функциями расстояния между ядрами: 
Графическая иллюстрация.
 энергия связи в молекуле.
энергия связи в молекуле.
 суммарная энергия 2 атомов.
суммарная энергия 2 атомов.
В случае с разнонаправленными спинами энергия не просто спадает, а проходит через некоторый минимум, отстоящей на  от
от 
 - энергия, которую нужно сообщить, чтобы диссоциировать молекулу.
- энергия, которую нужно сообщить, чтобы диссоциировать молекулу.
Ядра молекул могут совершать колебания/вращения около общего центра масс. Естественно, что с этими видами движения связаны изменения, отражающиеся на спектре.
В первом приближении все виды передвижений можно считать независимыми. Полная энергия стационарного состояния: 
Значения энергий могут принимать лишь дискретные значения.
В первом приближении можно считать колебания незатухающими. Тогда можем рассматривать обычный гармонический осциллятор.

Уравнение Шредингера принимает вид:

Это уравнение имеет конечное и однозначное решение, если собственное значение энергии принимает дискретное значение.
 v – колебательное квантовое число (0,1,2...)
v – колебательное квантовое число (0,1,2...) 
 - момент импульса
- момент импульса
Согласно правилу квантовой механики, 
Как показывают эксперименты, 
 энергетический зазор между вращательными уровнями.
энергетический зазор между вращательными уровнями.  энергетический зазор между колебательными уровнями.
энергетический зазор между колебательными уровнями. 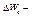 энергетический зазор между электронными уровнями.
энергетический зазор между электронными уровнями.
Молекулярные спектры всегда содержат электр., вращ., колебательные спектральные линии.
Если происходит воздействие на молекулу, сначала изменяются (или появляются) вращательные спектральные линии.
Только потом колебательные, потом – электронные.
Реализация – принцип работы лазера.
|
Просмотров 846 |
|
|
