
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Химическая кинетика .Химическое равновесие
|
|
Содержание работы
Целью работы является решение экспериментальных задач по химической кинетике, определении зависимости скорости химической реакции от концентрации реагирующих веществ, температуры, наличия катализатора и расчета условий химического равновесия в системах с обратимыми химическими реакциями.
Скорость химической реакции – изменение концентрации вещества в единицу времени в единице реакционного пространства

Скорость химической реакции всегда остается положительной, хотя отношения
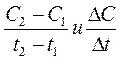 могут быть положительными, так и отрицательными в зависимости от того, концентрация какого из реагирующих веществ измеряется.
могут быть положительными, так и отрицательными в зависимости от того, концентрация какого из реагирующих веществ измеряется.
Скорость зависит от природы реагирующих веществ, их концентрации, температуры, наличие катализатора и других факторов.
Зависимость скорости химической реакции от концентрации реагирующих веществ можно изучить на примере самопроизвольного разложения тиосерной кислоты H2S2O3 при различных ее концентрациях, но при постоянной температуре. Известно, что тиосерная кислота в отличии от ее солей, неустойчива и самопроизвольно разлагается с образованием сернистой кислоты и свободной серы. Сернистая кислота, в свою очередь, разлагается до сернистого газа и воды. Т.е. при добавлении к раствору соли тиосерной кислоты, например, серной кислоты, протекают следующие реакции:
Na2 S2 O3 + H2 S O4 = H2S2O3 + Na2SO4
H2S2O3 = H2SO3 + S
H2S2O3 = H2 O + SO2 и суммарное уравнение
Na2S2O3 + H2S O4 = Na2SO4 + S + H2 O + SO2
Первая реакция идет практически мгновенно, точно так же устанавливается равновесие между H2SO3 H2O и SO2 . а скорость всего процесса определяется скорость самой медленной, второй, реакции.
Согласно закону действия масс скорость химической реакции прямо пропорциональна концентрации реагирующих веществ
аА + bВ → авАВ
Vх.р. = К[ А ]а [В ]в , где К – константа скорости химической реакции.
Скорость химической реакции вырастает в большей степени при увеличении концентрации всех реагентов, а при увеличении концентрации только одного из них возрастает в большей степени в том случае, если это вещество имеет больший стехиометриче6ский коэффициент в уравнении данной реакции.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа
Vt = VH * 
где Vt – скорость реакции при заданной температуре;
VH - скорость реакции при начальной температуре;
 - температурный коэффициент.
- температурный коэффициент.
При повышении температуры увеличивается число активных молекул, а, следовательно, увеличивается скорость их взаимодействия, т.е. скорость реакции. Изменение скорости химической реакции с температурой характеризуется температурным коэффициентом скорости, который представляет собой отношение констант скоростей при температурах (Т+10) и T=  , а т. к. скорости реакций связаны с константами скорости, то
, а т. к. скорости реакций связаны с константами скорости, то
T=  =
= 
Скорость реакции зависит от наличия катализатора. При гомогенном катализе катализатор и реагенты находятся в одной и той же фазе. Катализаторы, образующие самостоятельную фазу, составляют вместе с реагентами и продуктами реакции гетерогенную систему. Катализатор может многократно участвовать в промежуточных химических взаимодействиях, но обычно его количество значительно меньше, чем реагентов. Катализатор не может сместить химическое равновесие, он может способствовать более быстрому его достижению, причем катализатор в равной степени ускоряет прямую и обратную реакции.
Порядок выполнения работы
Задание 1. Изучение влияния на скорость химической реакции различных факторов
|
Просмотров 1268 |
|
|
