
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Опыт 1. Соединения серы (IV) в ОВР
|
|
В первую пробирку раствора дихромата калия  и во вторую с сульфидом калия
и во вторую с сульфидом калия  S внести по несколько капель 2 н раствора серной кислоты и по 2-3 капли микрошпателя сульфита натрия
S внести по несколько капель 2 н раствора серной кислоты и по 2-3 капли микрошпателя сульфита натрия 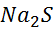 . Отметить наблюдаемые явления. Определить окислитель и восстановитель в каждой реакций. Составить уравнения проведенных реакций.
. Отметить наблюдаемые явления. Определить окислитель и восстановитель в каждой реакций. Составить уравнения проведенных реакций.
Опыт 2. Реакция диспропорционирования сульфита натрия.
В две пробирки поместить по 2-3 кристаллика сульфита натрия. Одну оставить в качестве контрольной. Вторую закрепить в штативе и нагревать в течении 5-6 минут. Дать остыть. В обе пробирки внести по 5-6 капель дистиллированной воды, размешать стеклянной палочкой до растворения солей, находящихся в пробирках. Добавить в каждую пробирку по 2-3 капли раствора сульфата меди (ΙΙ). Отметить наблюдаемые явления. Написать уравнения реакции разложения сульфита натрия, учитывая, что вторым продуктом прокаливания является сульфат натрия. Как изменялась степень окисления серы в данной реакции? Для каких степеней окисления серы возможны реакции диспропорционирования?
Задание 2. Изучение окислительно-восстановительных свойств в различных средах
Опыт 3.В три пробирки внести по 3-4 капли раствора перманганата калия  . В одну пробирку добавить 2-3 капли 2 н раствора серной кислоты, во вторую – столько же воды, в третью – такое же количество раствора щелочи. Во все три пробирки внести по 2 микрошпателя кристаллов нитрита калия и перемешать растворы до полного растворения кристаллов. Через 3-4 минуты отметить изменение окраски растворов во всех трех случаях.
. В одну пробирку добавить 2-3 капли 2 н раствора серной кислоты, во вторую – столько же воды, в третью – такое же количество раствора щелочи. Во все три пробирки внести по 2 микрошпателя кристаллов нитрита калия и перемешать растворы до полного растворения кристаллов. Через 3-4 минуты отметить изменение окраски растворов во всех трех случаях.
Написать уравнение реакции восстановления  нитритом калия в кислой, нейтральной и щелочной средах. Сколько окислительных эквивалентов содержится в 1 моль
нитритом калия в кислой, нейтральной и щелочной средах. Сколько окислительных эквивалентов содержится в 1 моль  в каждом из этих случаев?
в каждом из этих случаев?
Задание 3. Определение направления протекание ОВР
Опыт 4.Внести в пробирку по 2-3 капли сульфата хрома (ΙΙΙ) и сульфата калия и добавить к ним 1-2 капли иодной воды. Происходит ли окисление хрома (ΙΙΙ) иодом, которое должно сопровождаться обесцвечиванием иода?
В другую пробирку внести по несколько капель раствора бихромата калия и серной кислоты, затем добавить 3-4 капли иодида калия. Почему раствор окрасился в коричневый цвет? Составить уравнение полуреакций окисления и восстановления для протекающей ОВР. Рассмотреть данную реакцию как процесс, протекающей при работе гальванического элемента. Выписать значения соответствующих электродных потенциалов и вычислить э.д.с. Отметить значение э.д.с. для данного процесса, определить окислитель и восстановитель. Пользуясь электродными потенциалами, решить вопрос, возможна ли при стандартных условиях реакция
 +
+ 
Задание 4. Образование гальванических пар при химических процессах.
Опыт 5.Внести в пробирку 5-6 капель 2 н серной кислоты и кусочек чистого цинка (без примесей). Наблюдается ли вытеснение водорода из серной кислоты? Коснуться медной проволокой кусочка цинка в пробирке. Какова интенсивность выделения водорода и на каком из металлов он выделяется? Отнять медную проволоку от цинка и убедиться, что интенсивность выделения водорода снова изменяется. Указать направление перехода электронов в паре цинк-медь. Какой металл будет иметь отрицательный заряд и являться катодом для ионов водорода, имеющихся в растворе?
Опыт 6. В две пробирки внести по 5-6 капель 2 н раствора серной кислоты. В одну из пробирок прибавить каплю раствора сульфата меди и в обе пробирки опустить по кусочку чистого цинка. Наблюдать различную интенсивность выделения водорода в пробирках. Что появилось на поверхности цинка в присутствии сульфата меди? Какова роль соли меди, в присутствии которой водород выделяется интенсивнее?
Опыт 7. Коррозия оцинкованного и луженого железа
В две пробирки налить ½ их объема дистиллированной воды и добавить по 2-3 капли раствора 2 н серной кислоты гексацианоферрата (ΙΙΙ) калия  ] (Последний является чувствительным реактивом на ионы
] (Последний является чувствительным реактивом на ионы  , с которыми дает синее окрашивание). Растворы перемешать стеклянной палочкой. Две железные проволочки очистить наждачной бумагой. Одной проволокой прочно обмотать кусочек цинка, другой – кусочек олова и опустить их оба приготовленные растворы. Наблюдать синее окрашивание в одной из пробирок. (в какой?) Объяснить появление ионов
, с которыми дает синее окрашивание). Растворы перемешать стеклянной палочкой. Две железные проволочки очистить наждачной бумагой. Одной проволокой прочно обмотать кусочек цинка, другой – кусочек олова и опустить их оба приготовленные растворы. Наблюдать синее окрашивание в одной из пробирок. (в какой?) Объяснить появление ионов  в растворе. Дать схему перехода электронов при коррозии оцинкованного и луженого железа и указать, в каком случае при местном разрушении защитного покрытия будет происходить ржавление железа под остающимся неизменным защитным слоем.
в растворе. Дать схему перехода электронов при коррозии оцинкованного и луженого железа и указать, в каком случае при местном разрушении защитного покрытия будет происходить ржавление железа под остающимся неизменным защитным слоем.
Контрольные вопросы и задачи:
1. Сущность ОВР
2. Виды ОВР
3. Основные окислители и восстановители
4. Методы нахождения коэффициентов для ОВР: а) метод электронного баланса; б) метод полуреакций (ионно-электронный метод).
5. Найти окислитель и восстановитель и составить ОВР для процессов используя метод полуреакции:
 …
…
 +
+  …
…
S+  …
…
NaI+Na 

6. На основе стандартных электродных потенциалов определить, можно ли действием галогена на Fe (ΙΙ) перевести его в Fe (
Лабораторная работа №7
Гидролиз
Содержание работы
Целью работыявляется исследование процесса гидролиза солей и установление факторов, влияющих на гидролиз.
При растворении некоторых солей в воде нарушается равновесие диссоциации воды. Это является результатом обменных реакций растворенного вещества с растворителем, приводящих к образованию труднорастворимых, газообразных и малодиссоциирующих соединений. Такое обменное взаимодействие растворенного вещества с водой называется гидролизом.
В зависимости от природы растворенного вещества, его гидролиз может происходить по-разному. Так если соль образована сильной кислотой и основанием равной силы, то она полностью распадается в воде на свои составные части, а ее катионы и анионы, сталкиваясь с ионами Н+ и ОН- , практически ими не связываются. Происходит это по тому, что получающиеся в результате такого столкновения сильные кислота и основание, вновь моментально распадаются на ионы. Поэтому равновесие электролитической диссоциации воды не смещается, концентрация ионов водорода и гидроксида остается постоянной, равной 10-7моль/литр.
Гидролизу подвергаются все остальные соли:
· образованные катионом сольного основания и анионом слабой кислоты – происходит гидролиз по аниону;
· образованные катионом слабого основания и анионом сильной кислоты – происходит гидролиз по катиону;
· образованные катионом слабого основания и анионом слабой кислоты – происходит гидролиз и по катиону и по аниону.
Процесс гидролиза количественно характеризуется степенью гидролиза (h) и константой гидролиза (Кг). Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу (Сгидр.), к общему числу растворенных молекул (Собщ.):

Степень гидролиза зависит от следующих факторов:
1. природы соли;
2. ее концентрации;
3. температуры раствора.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (воды) и приводит к усилению гидролиза. Гидролиз концентрированных растворов происходит слабее. Процесс гидролиза эндотермичен, по этому с повышением температуры протекает полнее. Следовательно при гидролизе соблюдается принцип Ле-Шателье.
Константой гидролиза (Кг) называется - отношение произведения концентрации продуктов гидролиза к концентрации негидролизованной соли (определяется обычно по таблицам).
Величина Кг, в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой отношением аналогичным закону разбавления:

где С – исходная концентрация соли в растворе, (моль/литр).
Если степень гидролиза мала (h << 1), то Кг = h2*С,

Пример 5.
Составьте молекулярное и ионно-молекулярное уравнение гидролиза солей: а) NaCN , б) К2СО3
Решение:
а) Цианид натрия NaСN – соль слабой одноосновной кислоты HCN и сильного основания NaOH. При растворении в воде молекулыNaCN полностью диссоциируют на катионы Na+ и анионы CN . Катионы Na+ не могут связывать ионы ОН- воды , так как NaOH – сильный электролит . Анионы же CN-связывают ионы Н+ воды , образуя молекулы слабого электролита HCN . Соль гидролизуется , как говорят , по аниону. Ионно-молекулярное уравнение гидролиза:
CN- + H2O ⇄ HCN + OH-
или в молекулярной форме:
NaCN + H2O ⇄ HCN + NaOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, поэтому раствор NaCN имеет щелочную реакцию (рН > 7).
б) Карбонат калия K2CO3 – соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО32-, связывая водородные ионы воды, образуют анионы кислой соли НСО3-, а не молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени, соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
СО32- + НОН ⇄НСО3- + ОН-
или в молекулярной форме:
К2СО3 + Н2О ⇄ НСО3 + КОН
В растворе появляется избыток ионов ОН- ,поэтому раствор К2СО3 имеет щелочную реакцию рН>7.
Пример 6.
Составьте молекулярное и ионно-молекулярное уравнение реакции гидролиза соли CuCl2 .
Решение:
Хлорид меди – соль слабого многокислотного основания Cu(OH)2 и сильной кислоты HCl . В данном случае катионы Cu2+ связывают гидроксильные ионы воды, образуя катионы основной соли CuOH+. Образование молекул Сu(OH)2 не происходит, так как ионыCuOH+ диссоциируют гораздо треднее, чем молекулы Cu(OH)2.
В обычных условиях гидролиз идет по первой ступени.
Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
Cu2+ + H2O ⇄ CuOH+ + H+
или в молекулярной форме:
CuCl2 + H2O ⇄CuOHCl + HCl
В растворе появляется избыток ионов водорода, поэтому раствор ZnCl2 имеет кислую реакцию (рН > 7) .
Пример7.
Составьте молекулярное и ионно-молекулярное уравнение реакции гидролиза соли Pb(CH3COO)2 .
Решение:
Ацетат свинца – соль слабого многокислотного основания Pb(OH)2 и слабой одноосновной кислоты CH3COOH. В данном случае параллельно протекают два процесса:
Pb+2 + H2O⇄PbOH+ + H+
СН3СОО- + Н2О⇄СН3СОО + ОН-
Ионно - молекулярное уравнение:
Pb2+ + СН3СОО- + Н2О ⇄ PbOH+ + СН3СООН
или в молекулярной форме:
Pb(СН3СОО)2 + Н2О ⇄ PbOHСН3СОО + СН3СООН
Реакция раствора при этом зависит от относительной силы кислоты и основания, образующих соль. Если Ккисл. = Косн., то катион и анион гидролизуются в равной степени и реакция раствора будет нейтральной (рН = 7). Если Ккисл. > Косн., то катион солигидролизуется в большей степени, чем анион, и концентрации ОН- - ионов. В данном случае реакция раствора слабокислая. Наконец, если Ккисл. < Косн., то гидролизу преимущественно подвергается анион соли, и реакция раствора будет слабощелочной.
Пример 8.
Какие продукты образуются при смешивании растворов солей Fe(NO3)3 и Na2CO3? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение: Соль Fe(NO3)3 гидролизуется по катиону, а Na2CO3 – по аниону.
Fe3+ + Н2О ⇄ FeОН2+ + Н+
CO32־ + Н2О ⇄ НСО־3- + ОН
Гидролиз этих солей обычно ограничивается первой ступенью. При смешивании растворов этих солей ионы Н+ и ОН־взаимодействуют, образуя молекулы слабого электролита. Это приводит к тому, что усиливается гидролиз каждой из солей до образования осадка и газа: Fe(ОН)3 и СО2
Ионно-молекулярное уравнение
2 Fe+3 + 3CO32- + 3Н2О = 2Fe(ОН)2¯ + СО2
Молекулярное уравнение
2Fe(NO3)3 + 3Na2CO3 + 3Н2О = 2Fe(ОН)2¯ + 3СО2 + 6Na NO3
Для воды и ее растворов произведение концентрации ионов Н+ и ОН- величина постоянная при данной температуре и называется ионным произведением воды Кв. При 25оС Кв = [H+] · [OH-] = 1·10-14. Постоянство ионного произведения воды дает возможность вычислить концентрацию одного вида ионов, если известна концентрация другого вида ионов, а именно:



В чистой воде [H+] = [OH-] =  = 10-7 моль/л
= 10-7 моль/л
Концентрация ионов водорода указывает на характер среды:
[H+] = [OH-] = 10-7 моль/л, нейтральная среда;
[H+] > 10-7 моль/л, кислая среда;
[H+] < 10-7 моль/л, щелочная среда.
Для удобства оценки кислотности и щелочности среды пользуются не концентрацией водородных ионов, а величиной водородного показателя рН, он равен отрицательному десятичному логарифму концентрации водородных ионов рН = -lg[H+], следовательно, в щелочной среде рН > 7; в нейтральной среде рН = 7, в кислой среде рН < 7.
Пример 10. Вычислить рН раствора, если [H+] = 0,0001 = 10-4 моль/л.
Решение: [H+]= 0,0001 = 10-4 моль/л.
рН = -lg10-4 = 4; рН = 4
Порядок выполнения работы
|
Просмотров 1784 |
|
|
