
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Явление изомерии органических соединений, ее типы
|
|
Предмет и роль органической химии. Теория химического строения органических соединений А.М. Бутлерова и ее значение.
Органическая химия, наука, изучающая соединения углерода с другими элементами (органические соединения), а также законы их превращений.
Многообразие и громадное число органических соединений определяет значение органической химии как крупнейшего раздела современной химии. Окружающий нас мир построен главным образом из органических соединений; пища, топливо одежда, лекарства, краски, моющие средства, взрывчатые вещества, материалы, без которых невозможно создание транспорта, книгопечатания, проникновение в космос и прочее, - все это состоит из органических соединений. Важнейшую роль органические соединения играют в процессах жизнедеятельности. Органическая химия изучает не только соединения, получаемые из растительных и животных организмов (так называемые природные вещества), но в основном соединения, созданные искусственно с помощью лабораторного или промышленного органического синтеза.
Основные положения теории химического строения А.М. Бутлерова
1.Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
3.Свойства веществ зависят от их химического строения.
4.По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
5.Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
№2.
Явление изомерии органических соединений, ее типы.
В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом, изомерия - это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства.
Например, при содержании в молекуле 4-х атомов углерода и 10-ти атомов водорода возможно существование 2-х изомерных соединений: 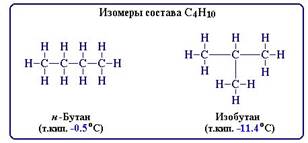
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию.
Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е. химическим строением.
Например, составу C5H12 соответствует 3 структурных изомера:

Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле.
Пространственными изомерами являются оптические и цис-транс изомеры. Молекулы таких изомеров несовместимы в пространстве. 
№3.
Электронные представления в органической химии. Строение атома углерода. Гибридизация орбиталей (валентные состояния атома углерода). Ковалентная связь и ее виды (простая, или δ- и кратные).
Применение электронной теории строения атома и химической связи в органической химии явилось одним из важнейших этапов развития теории строения органических соединений. Понятие о химическом строении как последовательности связей между атомами (А.М. Бутлеров) электронная теория дополнила представлениями об электронном и пространственном строении и их влиянии на свойства органических соединений. Именно эти представления дают возможность понять способы передачи взаимного влияния атомов в молекулах (электронные и пространственные эффекты) и поведение молекул в химических реакциях.
Согласно современным представлениям свойства органических соединений определяются:
· природой и электронным строением атомов;
· типом атомных орбиталей и характером их взаимодействия;
· типом химических связей;
· химическим, электронным и пространственным строением молекул.
Атом углерода состоит из ядра, имеющего положительный заряд +6 (так как содержит шесть протонов), и электронной оболочки, на которой находятся шесть электронов, расположенных на двух энергетических уровнях (слоях). Электронная конфигурация в основном состоянии 1s22s22p2.

В нормальном (невозбужденном) состоянии атом углерода имеет два неспаренных 2р2-электрона. В возбужденном состоянии (при поглощении энергии) один из 2s2-электронов может переходить на свободную р-орбиталь. Тогда в атоме углерода появляется четыре неспаренных электрона:

Гибридизацией орбиталей называется процесс выравнивания их по форме и энергии. Число гибридных орбиталей равно числу исходных орбиталей. По сравнению с ними гибридные орбитали более вытянуты в пространстве, что обеспечивает их более полное перекрывание с орбиталями соседних атомов.

|
Всего для атома углерода возможны три валентных состояния с различным типом гибридизации. Кроме sр3-гибридизации существует sр2- и sр-гибридизация.
sр2-Гибридизация – смешивание одной s- и двух р-орбиталей. В результате образуются три гибридные sр2-орбитали. Эти sр2-орбитали расположены в одной плоскости (с осями х, у) и направлены к вершинам треугольника с углом между орбиталями 120°.Негибридизованная р-орбиталь перпендикулярна к плоскости трех гибридных sр2-орбиталей (ориентирована вдоль оси z).

|
sр-Гибридизация – это смешивание (выравнивание по форме и энергии) одной s- и одной р-орбиталей с образованием двух гибридных sр-орбиталей. sр-Орбитали расположены на одной линии (под углом 180°) и направлены в противоположные стороны от ядра атома углерода. Две р-орбитали остаются негибридизованными. Они размещены взаимно перпендикулярно направлениям  -связей.
-связей. 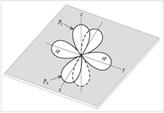
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществленной электронной парой, такая связь называется неполярной ковалентной связью.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает такой же по величине положительный заряд. Такая ковалентная связь называется полярной.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляют один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь. Этот вид ковалентной связи образуется между атомом, обладающим неподеленной парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
· Окисление (перенос одного электрона);
· Обобществление неспаренных электронов.
σ-связь (сигма-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии». Характеризуется осевой симметрией. Связь, образующаяся при перекрывании гибридных орбиталей вдоль линии, соединяющей ядра атома.


№4.
Классификация органических соединений. Функциональные группы и важнейшие классы органических соединений. Гетерофункциональные соединения. Качественный функциональный анализ (химическая идентификация классов органических соединений).

Ациклические соединения (жирные или алифатические) – соединения, молекулы которых содержат открытую (незамкнутую в кольцо) неразветвленную или разветвленную углеродную цепь с простыми или кратными связями. Ациклические соединения подразделяются на две основные группы:
• насыщенные (предельные) углеводороды (алканы), у которых все атомы углерода связаны между собой только простыми связями;
• ненасыщенные (непредельные) углеводороды (алкены, алкины и алкадиены), у которых между атомами углерода кроме одинарных простых связей, имеются также и двойные, и тройные связи.
Циклические соединения в свою очередь делятся на две большие группы:
- карбоциклические соединения – соединения, циклы которых состоят только из атомов углерода; Карбоциклические соединения подразделяются на алициклические– насыщенные (циклопарафины) и ароматические;
- гетероциклические соединения – соединения, циклы которых состоят не только из атомов углерода, но атомов других элементов: азота, кислорода, серы и др.
К «Другим классам органических соединений» относятся следующие:спирты, альдегиды, карбоновые кислоты, сложные эфиры, жиры, углеводы, амины, аминокислоты, белки, нуклеиновые кислоты.
| Классы органических соединений | Функциональные группы | ||
| Алканы | 
| ||
| Алкины | 
| ||
| Алкены | 
| ||
| Бензолы | 
| ||
| Нитросоединения | 
| ||
| Галогенпроизводные |
| ||
| Пероксиды |  , , 
| ||
| Сульфиды | 
| ||
| Простые эфиры | 
| ||
| Амины |
| ||
| Фенолы |
| ||
| Спирты | 
| ||
| Кетоны |
| ||
| Альдегиды | 
| ||
| Сложные эфиры | 
| ||
| Карбоновые кислоты | 
|
Большинство органических веществ, участвующих в процессах метаболизма, относятся к гетерофункциональным соединениям, т.е. имеющим в структуре несколько различных функциональных групп. Наиболее распространенными гетерофункциональными соединениями являются аминоспирты, аминокислоты, оксикислоты и оксокислоты. Химические свойства гетерофункциональных соединений нельзя рассматривать как сумму свойств, обусловленных наличием каждой функциональной группы. Так как функциональные группы влияют друг на друга, то у гетерофункциональных соединений появляются и специфические химические свойства.
Качественный анализ имеет своей целью обнаружение определенных веществ или их компонентов в анализируемом объекте. Обнаружение проводится путем идентификации веществ, то есть установления тождественности (одинаковости) АС анализируемого объекта и известных АС определяемых веществ в условиях применяемого метода анализа. Для этого данным методом предварительно исследуют эталонные вещества, в которых наличие определяемых веществ заведомо известно.
№5.
|
Просмотров 5150 |
|
|




