
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Классификация органических реакций (по характеру химических превращений и по механизму протекания). Гомолитические (радикальные) и гетеролитические (ионные) реакции
|
|
Реакции классифицируют по характеру химических превращений или по механизму их протекания.
I. По характеру химических превращенийорганические реакции делят на следующие типы:
· Реакции замещения. Один атом (или группа атомов) замещается на другой атом (или группу атомов) с образованием новой молекулы:
· Реакции присоединения. Из двух или нескольких молекул образуется одно новое вещество. Как правило, в таких реакциях происходит присоединение различных реагентов к кратным связям. К реакциям присоединения также можно отнести реакции восстановления. Частным случаем реакций восстановления являются реакции гидрирования – присоединения водорода:
· Реакции отщепления, или элиминирования. В результате этой реакции образуется новое вещество, молекулы которого часто содержат кратную связь.
· Реакции перегруппировки, или изомеризации. Такие реакции приводят к внутримолекулярным перемещениям атомов или групп атомов без изменения формулы веществ, участвующих в реакциях.
· Окисление. Реакция, при которой под действием окисляющего реагента образуется одно или несколько новых кислородсодержащих веществ.
· Реакции конденсации и поликонденсации являются также частным случаем реакции присоединения. В результате соединения нескольких молекул друг с другом, сопровождающегося выделением простых веществ (Н20, NH3, НСl и др.), образуется сложное вещество с высокой молекулярной массой.
· Реакции разложения (расщепления) приводят к образованию новых веществ более простого строения.
II. По механизму протеканияорганические реакции делят на следующие типы:
·  Гомолитические, или радикальные, реакции идут с участием атакующих реагентов свободных радикалов – частиц с неспаренным электроном. Каждый фрагмент (осколок) молекулы получает по одному электрону от прежней пары. Частицы (атомы или группы атомов), имеющие неспаренные электроны, называют радикалами (или свободными радикалами).
Гомолитические, или радикальные, реакции идут с участием атакующих реагентов свободных радикалов – частиц с неспаренным электроном. Каждый фрагмент (осколок) молекулы получает по одному электрону от прежней пары. Частицы (атомы или группы атомов), имеющие неспаренные электроны, называют радикалами (или свободными радикалами).
·  Гетеролитические, или ионные, реакции идут с участием ионов, а также частиц с неподеленной парой электронов или вакантной орбиталью, то есть нуклеофилов и электрофилов. Если атакующая частица (реагент) является нуклеофилом, то говорят, что реакция нуклеофильная. Если атакующая частица является электрофилом, то реакция считается электрофильной. Разрыв химической связи, при котором оба связывающих электрона переходят к одной из образующихся частиц.
Гетеролитические, или ионные, реакции идут с участием ионов, а также частиц с неподеленной парой электронов или вакантной орбиталью, то есть нуклеофилов и электрофилов. Если атакующая частица (реагент) является нуклеофилом, то говорят, что реакция нуклеофильная. Если атакующая частица является электрофилом, то реакция считается электрофильной. Разрыв химической связи, при котором оба связывающих электрона переходят к одной из образующихся частиц.
№6.
Элементный состав органических соединений. Качественный элементный анализ органических соединений, его роль в идентификации углеводов (простых и сложных), белков и изделий из полимерных материалов (природных и синтетических) методом разрушающего химического контроля.
Качественный элементный анализ — это совокупность методов, позволяющих установить, из каких элементов состоит органическое соединение. Для определения элементного состава органическое вещество предварительно путем окисления или минерализации (сплавлением со щелочными металлами) превращают в неорганические соединения, которые затем исследуют обычными аналитическими методами.
№7.
Алканы. Гомологический ряд предельных углеводов, общая формула. Изомерия, номенклатура, способы получения. Строение молекулы метана. Химические свойства (реакции замещения, цепной радикальный механизм; окисление, дегидрирование, крекинг).
Алканы — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
| Гомологический ряд алканов | ||
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H |
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета.

По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан".
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, называемые углеводородными радикалами. Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания –ан на -ил.
| Одновалентные радикалы | |||
| Метил | CH 3 - | Гексил | C 6 H 13 - |
| Этил | C 2 H 5 - | Гептил | C 7 H 15 - |
| Пропил | C 3 H 7 - | Октил | C 8 H 17 - |
| Бутил | C 4 H 9 - | Нонил | C 9 H 19 - |
| Пентил | C 5 H 11 - | Децил | C 10 H 21 - |
ПОЛУЧЕНИЕ.
| 1.Действие металлического натрия на моногалогенпроизводные (Реакция Вюрца) |
| C2H5I+CH3I+2Na=C3H8+2NaI |
| 2. Восстановление непредельных углеводородов |
H3C- CH=CH2+H2  H3C-CH2-CH3 H3C-CH2-CH3
|
| 3.Сплавление солей карбоновых кислот со щелочью |
CH3COONa + NaOH  Na2CO3+CH4 Na2CO3+CH4 
|
В молекуле метана химические связи атомов водорода с атомом углерода имеют ковалентный характер. Если перекрывающиеся попарно электронные облака при образовании связей обозначить двумя точками или валентной черточкой, строение метана можно выразить формулами:
 или
или 
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Галогенирование
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.
Хлорирование метана:

При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:

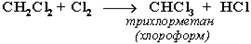

Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Нитрование алканов
На алканы действует разбавленная азотная кислота при нагревании и давлении. В результате происходит замещение атома водорода на остаток азотной кислоты – нитpогpуппу NO2. Эту реакцию называют реакцией нитрования, а продукты реакции – нитpосоединениями.
Схема реакции:

При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения:
Стрет.– Н > Свтор.– Н > Cперв.– Н
Например:

Окисление органического вещества – введение в его состав кислорода и (или) отщепление водорода. При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
Примеры:

При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO) происходит их каталитическое дегидрирование– отщепления атомов водорода за счет разрыва связей С—Н.

Строение продуктов дегидрирования зависит от условий реакции и длины основной цепи в молекуле исходного алкана.
1. Низшие алканы, содержащие в цепи от 2-х до 4-х атомов углерода, при нагревании над Ni-катализатором отщепляют водород от соседних углеродных атомов и превращаются в алкены
2. Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
3. При 1500 °С происходит межмолекулярное дегидрирование метана по схеме:

Крекинг– процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью.
Термический крекинг. При температуре 450–700 oС алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов. Например:
C6H14  C2H6 + C4H8
C2H6 + C4H8
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500°С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования.
№8.
Алкены. Гомологический ряд, общая формула. Изомерия, номенклатура, получение. Строение. Химические свойства. Правило Марковникова и его электронная трактовка. Реакция полимеризации. Промышленное использование этилена, пропилена и бутилена.
Алкены — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
| этен (этилен) | C2H4 |
| пропен | C3H6 |
| бутен | C4H8 |
| пентен | C5H10 |
| гексен | C6H12 |
| гептен | C7H14 |
| октен | C8H16 |
| нонен | C9H18 |
| децен | C10H20 |
Алкены, число атомов углерода в которых больше двух, (т.е. кроме этилена) имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная.
В соответствии с правилами ИЮПАК при построении алкенов наиболее длинная углеродная цепь, содержащая двойную связь, получает название соответствующего алкана, в котором суффикс -ан заменен на -ен. Эта цепь нумеруется таким образом, чтобы углеродные атомы, участвующие в образовании двойной связи, получили номера, наименьшие из возможных.
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы.
Способы их получения:
1. Крекинг алканов, входящих в состав нефти:
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Дегидрирование алканов:
| t, Cr2O3 | ||
| СН3-СН2-СН3 | → | СН3-СН=СН2 + Н2 |
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная p-связь.
Все специфические химические свойства алкенов определяются наличием в их молекуле p-электронного облака (то есть собственно двойной связью).
Реакции окисления. Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
1. Окисление при обычной температуре.
2. Горение алкенов. Как и алканы, непредельные соединения ряда этилена сгорают на воздухе с образованием оксида углерода (IV) и воды.
Реакция изомеризации. При нагревании или в присутствии катализаторов алкены способны изомеризоваться — происходит перемещение двойной связи или установление изостроения.
Реакции полимеризации. За счет разрыва p-связей молекулы алкена могут соединяться друг с другом, образуя длинные цепные молекулы.
Реакции присоединения.
1. Гидрирование (присоединение водорода). Алкены, присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды — алканы.
2. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных.
3. Гидрогалогенирование (присоединение галогеноводородов). Алкены легко присоединяют галогенводороды. Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова.
Правило Марковникова относится только к углеводородам (не имеющим никаких заместителей, кроме алкильных радикалов!) и звучит:

Современная электронная трактовка правила Марковникова позволяет объяснить и ряд случаев присоединения против этого правила. Так, присоединение электрофильных и нуклеофильных агентов к соединениям с сопряжёнными связями, содержащим электроотрицательную группировку у атома углерода двойной связи, происходит против правила Марковникова в соответствии со смещением электронной плотности к наиболее электроотрицательным атомам, например:

Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Пропиленв промышленности применяется, в основном, для синтеза полипропилена. Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр.
№9.
Алкадиены. Классификация, номенклатура. Строение, особенности образования p-связи и особенности химических свойств алкадиенов с сопряженными связями. Получение и практическое использование дивинила и изопрена. Каучуки.
Алкадиены представляют собой ненасыщенные углеводороды, содержащие в своем углеродном скелете две двойные связи.
При составлении названия алкадиена по номенклатуре ИЮПАК главную цепь необходимо выбирать так, чтобы в нее входили обе двойные связи. Нумеровать атомы в цепи нужно таким образом, чтобы атомы углерода, связанные двойными связями, получили минимальные номера. Названия диенов строятся все по тому же принципу, заменяя суффикс –ан в соответствующем алкане на –ен, поскольку, согласно определению, они содержат две двойные связи, то нужно добавить еще ди-, тогда получается –диен.
По принципу расположения двойных связей диены делятся на три группы:
· изолированные – двойные связи разделены двумя или более одинарными связями, т.е. между ними есть n(СН2)
· сопряженные – двойные связи разделены одной одинарной:
· кумулированные – двойные связи находятся при одном и том же атоме углерода.
Строение алкадиенов:
А) молекулярное
C4H6 –бутадиен
б) структурное
CH2 = CH– CH= CH2 - бутадиен-1,3
Напомним, что свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
2. Реакции полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов.
Дивинил (бутадиен) - один из основных мономеров синтетического каучука, используемый в производстве резины, исходя из бутадиен-стирольного каучука.
Существуют два принципиальных технологических подхода к получению дивинила. Это дегидрирование бутан-бутиленовой фракции нефти и традиционная реакция В. Н. Ипатьева - С.В. Лебедева, основанная на одновременном отщеплении водорода и воды из двух молекул этанола.
- Полимеризацией бутадиена получают синтетические каучуки.
- Сополимеризацией бутадиена с акрилонитрилом и стиролом получают АБС-пластик.
Изопрен — ненасыщенный углеводород диенового ряда (CnH2n−2). В нормальных условиях бесцветная жидкость.
В промышленном масштабе освоены шесть методов получения изопрена:
- из изобутилена и формальдегида;
- дегидрированием изопентана;
- окислительным дегидрированием изопентана;
- из пропилена;
- из ацетилена и ацетона;
- жидкофазным окислением углеводородов.
Изопрен применяют для получения синтетического каучука.
Каучукимеет громадное значение в народном хозяйстве. Синтез проходит в две стадии.
1. Получение бутадиена из этилового спирта в присутствии катализатора (Аl2О3, ZnO):

2. Полимеризация бутадиена в присутствии металлического натрия:

Строение бутадиенового каучука описывается формулой (-СН2-СН=СН-СН2-)n
№10.
Алкины. Гомологический ряд ацетиленовых углеводородов, общая формула. Изомерия, номенклатура, получение. Строение, химические свойства. Практическое использование ацетилена и винилацетилена.
Алкины — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Гомологический ряд алкинов:
- Этин: C2H2
- Пропин: C3H4
- Бутин: C4H6
- Пентин: C5H8
- Гексин: C6H10
- Гептин: C7H12
- Октин: C8H14
- Нонин: C9H16
- Децин: C10H18
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами. Углеводородные радикалы, образованные от алкинов имеют суффикс «-инил», так CH≡C- называется «этинил».
Получение:
|
Просмотров 2453 |
|
|
