
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Нитроалканы и нитроарены. Строение нитрогруппы. Получение. Химические свойства. Применение
|
|
Электронодонорные и электроноакцепторные заместители. Правило ориентации в бензольном ядре при электрофильном замещении. Согласованная и несогласованное влияние заместителей. Отдельные представители и их применение.
| Орто- и Пара-ориентанты (ориентанты I рода) | Мета-ориентанты (ориентанты II рода) |
| -OH, -OR | -NO2, -CN |
| Alk: -CH3, -C2H5 и т.д. | -COOH, -COH |
| AR: -C6H5 и т.д. | -COOR, -COR |
| -NH2, -NHR, -NR2, -CONHR | -SO3H, -SO3R |
| Hal: -F, -Br, -Cl, -I |
Существенной особенностью реакций для получения и превращений производных ароматических углеводородов является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направление реакций замещения в бензольном ядре, называют правилами ориентации.
Реакционная способность того или иного атома углерода в бензольном кольце определяется следующими факторами: 1) положением и природой уже имеющихся заместителей; 2) природой действующего агента; 3) условиями проведения реакции. Решающее влияние имеют два первых фактора.
Заместители в бензольном кольце можно разделить на две группы.
Электронодонорные заместители (первого рода) – это группировки атомов, способные отдавать электроны. К ним относятся OH, OR, RCOO, SH, SR, NH2, NHR, NHCOR, -N=N-, CH3, CH2R, CR3, F, Cl, Br, I.
Электроноакцпторные заместители (второго рода) – это атомные группировки, способные оттягивать, принимать электроны от бензольного ядра. К ним относятся SO3H, NO2, CHO, COR, COOH, COOR, CN, CCl3 и т. д.
Действующие на ароматические соединения полярные реагенты можно разделить на две группы: электрофильные и нуклеофильные. Наиболее характерны для ароматических соединений процессы алкилирования, галогенирования, сульфирования и нитрования. Эти процессы идут при взаимодействии ароматических соединений с электрофильными реагентами.
Заместители первого рода (кроме галогенов) облегчают реакции с электрофиьными реагентами, причем они ориентируют новый заместитель в орто- и пара-положения.
Заместители второго рода затрудняют реакции с электрофильными реагентами: они ориентируют новый заместитель в мета-положение. В то же время эти заместители облегчают реакции в нуклеофильными реагентами.
Если в бензольном кольце есть заместители, то электронная плотность перераспределяется и становится неравномерной. Донорные заместители повышают электронную плотность кольца в орто- и пара-положениях. Акцепторные заместители понижают электронную плотность в этих положениях из-за значительного отрицательного мезомерного и индуктивного эффектов.
При наличии в кольце 2-х заместителей они могут направлять следующие заместители либо в одно и то же положение, либо в разные. Если оба ориентанта одного рода, то положение следующего заместителя определяет более сильный. В случае, если ориентанты не отличаются по силе, то образуется смесь продуктов.
Среди ориентантов I рода самыми сильными являются аминопроизводные, затем ароматические, самые слабые галогенпроизводные.
Среди ориентантов II рода самый сильный –NO2, затем -HSO3, далее -COOH.

Нитроалканы и нитроарены. Строение нитрогруппы. Получение. Химические свойства. Применение.
Нитросоединения (С-нитросоединения), содержат в молекуле одну или несколько нитрогрупп, непосредственно связанных с атомом углерода. Известны также N- и О-нитро-соединения.
Нитрогруппа имеет строение, промежуточное между двумя предельными резонансными структурами:

Группа планарна: атомы N и О имеют, sр2-гибридизацию, связи N—О равноценные и практически полуторные; длины связей, например для CH3NO2, 0,122 нм (N—О), 0,147 нм (С—N), угол ONO 127°. Система С—NO2 плоская с низким барьером вращения вокруг связи С—N.
Нитросоединения, имеющие хотя бы один α-Н-атом, могут существовать в двух таутомерных формах с общим мезомерным анионом. О-форма называется аци-нитросоединением или нитроновой кислотой:

Известны различные производные нитроновых кислот: соли формулы RR'C=N(O)O- M+ (соли нитросоединений), эфиры (нитроновые эфиры) и т.д. Эфиры нитроновых кислот существуют в виде цис- и транс-изомеров. Существуют циклические эфиры.
Названия нитросоединений производят прибавлением префикса "нитро" к названию соединения-основы, по необходимости добавляя цифровой указатель, напр. 2-нитропропан. Название солей нитросоединений производят из названия либо С-формы, либо аци-формы, или нитроновой кислоты.
Получение:
1) C2H5I + AgNO2 → C2H5NO2 + AgI
2)
3) C6H6 + HO-NO2 → C6H5-NO2 + H2O
4) Реакция Коновалова

Химические свойства:
1) Изомеризация нейтральных нитросоединений в кислые:

2) Взаимодействие с кислотами:

3) Восстановление:

4) Конденсация с альдегидами:


5) Нагревание с серной кислотой:

6) Замещение галогенами:


7) Ориентирование:
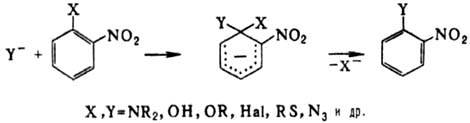
Применение:
Поли-нитросоединения, особенно ароматические, применяют в качестве взрывчатых веществ и в меньшей степени как компоненты ракетных топлив. Алифатические нитросоединения используют как растворители в лакокрасочной промышленности и в производстве полимеров, в частности эфиров целлюлозы; для очистки минеральных масел; депарафинизации нефти и др.
Ряд нитросоединений находят применение в качестве биологически активных веществ. Так, эфиры фосфорной кислоты, содержащие нитроарильный фрагмент,-инсектициды; производные 2-нитро-1,3-пропандиола и 2-нитростирола - фунгициды; производные 2,4-динитрофенола - гербициды; α-нитрофураны - важнейшие антибактериальные препараты, на их основе созданы лекарства, обладающие широким спектром действия (фуразолидин и др.). Некоторые ароматические нитросоединения -душистые вещества.
Нитросоединения - полупродукты в производстве синтетических красителей, полимеров, моющих препаратов и ингибиторов коррозии; смачивающих, эмульгирующих, диспергирующих и флотационных агентов; пластификаторов и модификаторов полимеров, пигментов и пр. Они находят широкое применение в органическом синтезе и в качестве модельных соединений в теоретической органической химии.
|
Просмотров 2211 |
|
|
