
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Двухосновные карбоновые кислоты. Способы получения. Химические свойства. Отдельные представители и их применение
|
|
Номенклатура. Кислоты с двумя СООН группами в молекуле являются двухосновными или дикарбоновыми. Многие из них имеют тривиальные названия, например, щавелевая, малоновая, янтарная, глутаровая, адипиновая, фталевая. По систематической номенклатуре к названию предельного углеводорода по числу атомов углерода в цепи, добавляется суффикс – диовая и слово кислота.
В зависимости от строения радикала различают насыщенные, ненасыщенные и ароматические дикарбоновые кислоты.
Получение:
1) Окисление гликолей:
2) Окисление дигалогенпроизводных:
Химические свойства.
Двухосновные кислоты вступают во все реакции, обусловленные наличием карбоксильной группы (образование солей, хлорангидридов, ангидридов, амидов, реакция этерификации и т.д.), но ступенчато.
1. Диссоциация. В растворах двухосновные кислоты ступенчато диссоциируют на ионы.
Двухосновные кислоты всегда сильнее одноосновных кислот. Чем ближе друг к другу находятся СООН группы, тем выше их взаимное акцепторное влияние и больше значение pH данной кислоты. Самая сильная – щавелевая кислота (pКa1 = 1.27; pКa2 = 4.27). pКa1 почти в 2 раза выше, чем pКa2 .
Второй протон отщепляется труднее, чем первый. Для дикарбоновых кислот характерны все реакции одноосновных кислот: образование солей, эфиров, ангидридов, амидов, хлорангидридов.
2. Специфические свойства дикарбоновых кислот – отношение к нагреванию.
Щавелевая и малоновая кислоты легко декарбоксилируются при нагревании (140-1500С) с образованием муравьиной и уксусной кислот соответственно.
НООС-СООН → НСООН + СО2 ↑
Янтарная и глутаровая кислоты, содержащие СООН группы в положениях 1,4 и 1,5 при нагревании отщепляют воду и дают циклические ангидриды (циклодегидратация). Это связано с изогнутым строение углеродной цепи по типу «клешни» и устойчивостью образующихся при этом пяти- и шестичленных циклов.

Янтарная кислота используется как регулятор кислотности пищевых продуктов. Ее добавляют в безалкогольные напитки, сухие концентраты супов, бульоны, десертные смеси. Максимальный уровень содержания – 6 г на 1 кг продукта.
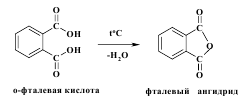
Аналогично поведению янтарной и глутаровой кислот ведет себя о-фталевая кислота. В ее структуре карбоксильные группа находятся в непосредственной близости друг от друга, что приводит к легкой дегидратации и образованию циклического фталевого ангидрида.
Адипиновая кислота имеет большое значение для получения полимеров.
25. Ароматические одно – и двухосновные кислоты (бензойная и фталевые кислоты). Способы получения. Химические свойства. Отдельные представители и их применение.
Органические соединения, содержащие карбоксильную группу СООН. По кол-ву этих групп различают моно-, ди- и многоосновные кислоты. Двухосновные ароматические кислоты имеющие общее название фталевые кислоты известны в 3 изомерах:
ортофталевая к-та;
метафталевая к-та;
терефталевая
Получение:
1) окисление гомологов бензола:
2) Гидролиз ароматических тригалогенидов:
3) Ацилирование бензола и его гомологов:
Химические свойства. Ароматические одно-основные к-ты – более сильные чем алифатические. Это объясняется значительной электроотрицательностью бензольного кольца, которое оттягивает электроны от карбонильной группы. Бензольное кольцо может проявлять и электронно-донорные свойства :
1) Этерификация. Заместители введенные в о-положение бензольного кольца, снижают скорость этерификации. Если оба о-положения заняты, то процесс этерификации прекращается из-за стерических препятствий:
2) Образование хлорангидридов. При действии на к-ты PCl3 SOCl2 получаются хлорангидриды:
3) Реакции ангидридов. Хлорангидриды с солями ароматических к-т образуют ангидриды:
Фталевые к-ты намного сильнее, чем бензойная.
Отдельные представители:
1) Бензойная кислота:
Применяется в пищевой промышленности (консервант).
2) Фталевые кислоты:
Получают окислением ксилолов и применяют для получения полимеров реакцией поликонденсации, используют как пластификатор.
3) Толуиловые кислоты:
Применяют для производства красителей, консервантов, душистых веществ.
|
Просмотров 1746 |
|
|
