
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Карбоновые кислоты. Номенклатура. Строение. Способы получения карбоновых кислот. Химические свойства. Механизм этерификации. Отдельные представители и их применение
|
|
Органические соединения, содержащие карбоксильную группу СООН. По кол-ву этих групп различают моно-, ди- и многоосновные кислоты. Алифатические кислоты, у которых число атомов С в молекуле больше 6, относят к высшим жирным кислотам.
По номенклатуре ИЮПАК, кислоты называют, выбирая за основу наибольшую длинную цепь, содержащую группу СООН, и добавляя к названию соединения-основы окончание "овая" и слово "кислота"; атому С карбоксильной группы приписывают номер 1, например СН3(СН2)4СН(СН3)СООН - 2-метилгептановая кислота. Часто к названию соединения-основы добавляют слова "карбоновая кислота", например С6Н11СООН - циклогексанкарбоновая кислота. При использовании этого способа наименования в алифатическому ряду атом С карбоксильной группы в нумерацию цепи не включается. Многие кислоты имеют тривиальные названия.
Свойства. Карбоксильная группа имеет строение, промежуточное между двумя предельными структурами:

Группа планарна; В твердом и жидком состоянии кислоты в результате возникновения водородных связей образуют устойчивые циклические димеры.

Получение:
1) Окисление альдегидов и первичных спиртов. В качестве окислителей применяются KМnО4 и K2Сr2О7.
R-CH2-OH → R-CH=O → R-CO-OH
спирт альдегид кислота
2) Гидролиз галогензамещенных углеводородов:
R-CCl3 + 3 NaOH → [R-C(OH)3] → R-COOH + Н2О + 3NaCl
3) Получение карбоновых кислот из цианидов (нитрилов)
CH3CN + 2Н2О → CH3COONH4.
CH3COONH4 + HCl → СН3СООН + NH4Cl
4) Использование реактива Гриньяра по схеме:
R-MgBr + СО2 → R-COO-MgBr + H2O → R-COOH + Mg(OH)Br
5) Гидролиз сложных эфиров:
R-COOR1 + КОН → R-COOK + R'OH ,
R-COOK + HCl → R-COOH + KCl .
6) Гидрокарбоксилирование алкенов и алкинов: 
Химические свойства.
Карбоксильная группа имеет Пи-Пи – сопряженную систему в результате взаимодействия Пи-орбитали кислорода гидроксильной группы с Пи-орбиталью атома углерода карбоксильной группы. Можно выделить реакционные центры:
1 ОН-кислотный центр. За счет которого карбоновые кислоты проявляют кислотные свойства
2 Электрофильный центр(-С=). При участии этого центра к-ты встпают в реакцию нуклеафильного замещения.
3 Основный центр – оксогруппа, со своей парой е, которая протонируется на стадии катализа в реакциях нуклеафильного замещения.
4 СН –кислотный центр – возникает у α-углеродного атома за счет индуктивного эффекта карбоксильной группы.
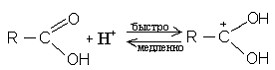
1) В водном растворе карбоновые кислоты диссоциируют:
RCOOH  RCOO- + Н+
RCOO- + Н+
2) Образование солей. Карбоновые к-ты вступают во взаимодействие с Ме, оксидами, щелочами, основаниями:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
3) Сложные эфиры. При взаимодействии карбоновых к-т со спиртами в присутствии кислых катализаторов – конц. Серная к-та,хлороводород. В случае сильных карбоновых к-т отпадает введение катализатора, т.к. они сами катализируют реакцию :

4) Действие галогенов:
СН3-СН2-СООН + Вr2 → СН3-СНВr-СООН + НВr
5) Непредельные кислоты:
СН2=СН-СООН + Н2 → СН3-СН2-СООН,
СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН,
СН2=СН-СООН + HCl → СН2Сl-СН2-СООН,
СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН,
6) Реакции декарбоксширования:
CH3-CH2-COONa + NaOH → С2Н6↑ + Na2CO3
7) Образование ангидридов. При отнятии молекулы воды от 2х молекул карбоновой к-ты образуется ее ангидрид:

8) Образование галогенангидридов. Галогенангидриды – продукты замещения гидроксильных групп в карбоксиле на галоген. Образуются при взаимодействии к-ты с галогенидами фосфора и тионилом(SOCl2):

Механизм этерификации. На стадии катализа протонируется карбонильный атом С. Гидроксильная группа не присоединяет ион Н,т.к. атом кислорода находится в сопряжении с карбонильной группой. Возникший карб-катион имеет более сильные электрофильные свойства, чем исходная карбоновая к-та. Следовательно может присоединять более слабый нуклеофил как спирт. В образовавшемся катионе перенос протона к одной из гидроксильных групп. Формируется уходящая группа НОН. После отщипления воды и возврата катализатора образуется сложный эфир:

Представители:
| Карбоновые кислоты | Формула | Ka |
| Пропионовая | CH3CH2COOH | 1,3*10-5 |
| Масляная | CH3CH2CH2COOH | 1,5*10-5 |
| Уксусная | CH3COOH | 1,7*10-5 |
| Кротоновая | CH3-CH=CH-COOH | 2,0*10-5 |
| Винилуксусная | CH2=CH-CH2COOH | 3,8*10-5 |
| Акриловая | CH2=CH-COOH | 5,6*10-5 |
| Муравьиная | HCOOH | 6,1*10-4 |
| Бензойная | C6H5COOH | 1,4*10-4 |
| Хлоруксусная | CH2ClCOOH | 2,2*10-3 |
| Тетроновая | CH3-C≡C-COOH | 1,3*10-3 |
| Дихлоруксусная | CHCl2COOH | 5,6*10-2 |
| Щавелевая | HOOC-COOH | 5,9*10-2 |
| Трихлоруксусная | CCl3COOH | 2,2*10-1 |
Кислоты исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы - компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
|
Просмотров 1028 |
|
|
