
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Бескислородные соединения галогенов
|
|
К этой группе можно отнести кислоту хлористоводородную (хлороводородную), натрия хлорид, калия хлорид, натрия бромид, калия бромид, натрия иодид и калия иодид.
11.2.1. Кислота хлористоводородная
Кислота хлороводородная или хлористоводородная (по терминологии ГФ XI) — продукт производства основной химической промышленности. Ее получают растворением в воде хлороводорода.
Основной промышленный способ получения хлороводорода — прямой синтез из водорода и хлора. Их предварительно получают при электролизе раствора хлорида натрия. Хлорид натрия в водном растворе диссоциирует на ионы:
NaCl ® Na+ + Cl–
При пропускании электрического тока на катоде и аноде происходят следующие процессы:
| Катод 2H2O + 2e– ® 2OH– + H2 | Анод 2Cl–– 2e– ® Cl2 | В прикатодном растворе: 2Na+ + 2OH– ® 2NaOH |
Суммарная схема процесса электролиза: 2NaCl + 2H2O ® Cl2 + 2NaOH + H2
Полученные водород и хлор взаимодействуют в контактных печах при высокой температуре:
H2 + Cl2 ® 2HCl + 187,4 кДж
Образующийся хлороводород пропускают через поглотительные башни с водой, в которых в результате адиабатической или изотермической абсорбции образуется хлористоводородная (хлороводородная) кислота. Этот промышленный способ позволяет получить хлороводородную кислоту, содержащую 35–36% хлороводорода. В последние годы в развитых странах более 90% хлороводородной кислоты получают из абгазов (побочных газов), содержащих хлороводород, образующийся при хлорировании и дегидрохлорировании органических соединений (например, при получении хлорбензола).
Применяют два лекарственных препарата кислоты хлористоводородной (табл. 11.2)
11.2. Свойства лекарственных препаратов кислоты хлористоводородной
| Лекарственный препарат | Описание | Плотность, г/см3 | Объемная доля, % |
| Acidum hydrochloricum— кислота хлористоводородная | Бесцветная прозрачная летучая жидкость со своеобразным запахом | 1,122–1,124 | 24,8–25,2 |
| Acidum hydrochloricum dilutum— кислота хлористоводородная разведенная | Бесцветная прозрачная жидкость кислой реакции | 1,038–1,039 | 8,2–8,4 |
В водных растворах хлороводород полностью диссоциирует с образованием хлорид-иона и гидратированного протона (оксоний-иона):
HCl + H2O ® Cl– + H3O+
Лекарственные препараты кислоты хлористоводородной смешиваются с водой и этанолом во всех соотношениях. Отличаются они только по содержанию хлороводорода и соответственно по плотности (см. табл. 11.2).
Хлорид-ион можно обнаружить с помощью нитрата серебра по образованию нерастворимого в воде и в растворе азотной кислоты, но растворимого в растворе аммиака осадка хлорида серебра:
HCl + AgNO3 ® AgCl¯ + HNO3
AgCl + 2NH3 · H2О ® [Ag(NH3)2]Cl + 2H2O
Второй способ обнаружения хлорид-иона основан на выделении свободного хлора при нагревании лекарственных препаратов с диоксидом марганца:
4HCl + MnO2 ® Cl2 + MnCl2 + 2H2O
Хлор обнаруживают по запаху.
Определяют содержание хлороводорода в лекарственных препаратах кислоты хлористоводородной методом кислотно-основного титрования, титруя раствором гидроксида натрия в присутствии индикатора метилового оранжевого:
HCl + NaOH ® NaCl + H2O
Содержание хлороводорода можно установить также аргентометрическим методом по хлорид-иону.
Применяют кислоту хлористоводородную разведенную при недостаточной кислотности желудочного сока. Назначают внутрь 2–4 раза в день во время еды по 10–15 капель (на 1/4 — 1/2 стакана воды).
11.2.2. Соединения хлоридов, бромидов, иодидов
Физические свойства, способы получения и испытания этих лекарственных веществ имеют много общего.
Натрия хлорид получают из минерала галита, а также из подземных рассолов, воды озер и морей выпариванием. Однако при этом остаются примеси. Очистку от них производят последовательно. Вначале раствором хлорида бария осаждают сульфаты и фосфаты:
Na2SO4 + BaCl2 ® BaSO4¯ + 2NaCl
Na2HPO4 + BaCl2 ® BaHPO4¯ + 2NaCl
Раствор натрия хлорида отделяют от осадка декантацией, нагревают и обрабатывают избытком карбоната натрия для осаждения примесей солей магния, кальция и бария:
MgCl2 + Na2CO3 ® MgCO3¯ + 2NaCl
CaCl2 + Na2CO3 ® CaCO3¯ + 2NaCl
BaCl2 + Na2CO3 ® BaCO3¯ + 2NaCl
Раствор вновь декантируют и нейтрализуют хлороводородной кислотой до удаления карбонатов:
Na2CO3 + 2HCl ® 2NaCl + CO2 + H2O
Затем раствор, содержащий только натрия хлорид, упаривают до начала кристаллизации. Кристаллы отфильтровывают и высушивают, нагревая до 200 °C.
В последнее время наиболее чистую «выварочную» соль (99,9%) получают упариванием естественных или искусственно приготовленных рассолов в вакуум-выпарительных аппаратах.
Источники получения калия хлорида — минералы сильвинит KCl × NaCl или карналлит KCl × MgCl2 × 6H2O. Из них выделяют калия хлорид методом флотации, а затем очищают, как и натрия хлорид.
Существуют различные способы промышленного получения бромидов. Один из них основан на использовании бромида железа (II) и (III), который является отходом некоторых химических производств или получается при обработке железных стружек бромом:
3Fe + 4Br2 ® Fe3Br8
[Бромид железа (II) и (III) имеет состав FeBr2 × 2FeBr3].
Раствор бромида железа (II) и (III) нагревают до кипения и прибавляют к нему раствор карбоната натрия (до щелочной реакции):
Fe3Br8 + 4Na2CO3 + 4H2O ® 8NaBr + 2Fe(OH)3¯ + Fe(OH)2¯ + 4CO2
По такой же схеме получают натрия или калия иодиды из иодида железа (II) и (III):
3Fe + 4I2 ® Fe3I8
Fe3I8 + 4Na2CO3 + 4H2O ® 8NaI + 2Fe(OH)3¯ + Fe(OH)2¯ + 4CO2
После отделения гидроксидов железа (II) и (III) фильтрат подкисляют соответственно бромоводородной или иодоводородной кислотой и сгущают до кристаллизации. Вначале кристаллизуются дигидраты, которые высушивают при 110–130 °С до образования безводной соли.
Широко применяют способ получения бромидов, основанный на взаимодействии брома с гидроксидом натрия или карбонатом натрия в присутствии восстановителей (формиата натрия):
Na2CO3 + 2HCOONa + 2Br2 ® 4NaBr + 3CO2 + H2O
Натрия иодид получают при взаимодействии иода и гидроксида натрия с последующим восстановлением иодата натрия сероводородом или пероксидом водорода:
3I2 + 6NaOH ® 5NaI + NaIO3 + 3H2O
4NaIO3 + 3H2S + 6NaOH ® 4NaI + 3Na2SO4 + 6H2O
11.3. Свойства хлоридов, бромидов, иодидов натрия и калия
| Лекарственное вещество | Химическая формула | Описание |
| Sodium Chloride (Natrii chloridum)— натрия хлорид | NaCl | Белые кубические кристаллы или белый кристаллический порошок без запаха, соленого вкуса |
| Potassium Chloride (Kalii chloridum)— калия хлорид | KCl | Бесцветные кристаллы или белый кристаллический порошок без запаха, соленого вкуса |
| Sodium Bromide (Natrii bromidum)— натрия бромид | NaBr | Белый кристаллический порошок без запаха, соленого вкуса. Гигроскопичен |
| Potassium Bromide (Kalii bromidum)— калия бромид | KBr | Бесцветные или белые кристаллы или мелкокристаллический порошок без запаха, соленого вкуса |
| Sodium Iodide (Natrii iodidum)— натрия иодид | NaI | Белый кристаллический порошок без запаха, соленого вкуса. Гигроскопичен |
| Potassium Iodide (Kalii iodidum)— калия иодид | KI | Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок без запаха, солено-горького вкуса. Гигроскопичен |
По физическим свойствам галогениды (табл. 11.3) представляют собой белые или бесцветные кристаллические вещества без запаха, соленого вкуса, легко (иодиды — очень легко) растворимые в воде. Иодиды легко растворимы также в этаноле и глицерине, хлориды и бромиды менее растворимы в этих растворителях.
Для испытания галогенидов на подлинность выполняют качественные реакции на соответствующие катионы и анионы, которые включены в общую статью (ГФ XI, вып. 1, с. 159).
Катион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет и по образованию зеленовато-желтого кристаллического осадка с цинкуранилацетатом (октаацетат-триуранилатом цинка) в уксуснокислой среде:
NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O ®
® NaZn[(UO2)3(CH3COO)9] × 9H2O¯ + HCl
Соли калия окрашивают бесцветное пламя горелки в фиолетовый цвет (при рассматривании через синее стекло — пурпурно-красный). Катион калия можно также обнаружить реакцией с винной кислотой (в нейтральной или уксуснокислой среде) по образованию белого кристаллического осадка:
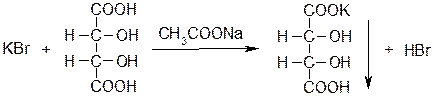
Осадок гидротартрата калия растворяется в разбавленных минеральных кислотах (с образованием винной кислоты) и в растворах гидроксидов щелочных металлов с получением двухзамещенных тартратов.
Соли калия в уксуснокислой среде (pH 4-6) образуют с гексанитрокобальтатом (III) натрия желтый кристаллический осадок:
2KBr + Na3[Co(NO2)6] ® K2Na[Co(NO2)6]¯ + 2NaBr
При действии щелочами происходит превращение в тёмно-бурый осадок гидроксида кобальта (III):
K2Na[Co(NO2)6] + 3NaOH ® Co(OH)3¯ + 2KNO2 + 4NaNO2
Осадок постепенно приобретает розовую окраску в связи с образованием гидроксида кобальта (II).
Галогенид-ионы можно обнаружить осадочной реакцией с раствором нитрата серебра в азотнокислой среде. Образуются труднорастворимые соли галогенидов серебра, которые отличаются по окраске и по растворимости в растворе аммиака (табл. 11.4).
11.4. Свойства галогенидов серебра
| Галогениды | Цвет осадка | Произведение растворимости | Растворимость в растворе аммиака |
| AgCl | Белый | 1,8·10–10 | Растворим |
| AgBr | Светло-желтый | 5,3·10–13 | Мало растворим |
| AgI | Желтый | 8,3·10–17 | Нерастворим |
Реакции идентификации бромидов и хлоридов проходят по одинаковой схеме. Например, для натрия бромида:
NaBr + AgNO3 ® AgBr¯ + NaNO3
AgBr + 2NH3 · H2О ® [Ag(NH3)2]Br + 2H2O
Иодид серебра комплексной соли с аммиаком не образует. Бромид и иодид серебра взаимодействуют с цинком в присутствии 0,1 М раствора серной кислоты:
2AgI + Zn ® 2Ag¯ + ZnI2
Бромиды и иодиды обнаруживают также с помощью реакций окисления галогенидов до свободных галогенов, используя различные окислители. Образующиеся галогены извлекают хлороформом и наблюдают окраску хлороформного слоя. Для обнаружения бромид-иона в качестве окислителя используют хлорамин в присутствии хлороводородной кислоты:

2KBr + Cl2 ® Br2 + 2KCl
Слой хлороформа окрашивается в желто-бурый цвет.
Иодид-ион окисляют раствором нитрита натрия или другим окислителем в кислой среде:
2NaNO2 + 2NaI + 2H2SO4 ® I2 + 2NO + 2Na2SO4 + 2H2O
Выделившийся иод окрашивает слой хлороформа в фиолетовый цвет. Бромиды можно также обнаружить по реакции с раствором сульфата меди (II) и концентрированной серной кислоты. Появляется черный осадок, исчезающий после добавления нескольких капель воды.
Иодиды под действием концентрированной серной кислоты выделяют фиолетовые пары иода. Из раствора иодидов при добавлении ацетата свинца выпадает осадок иодида свинца желтого цвета:
2NaI + (CH3COO)2Pb ® PbI2¯ + 2CH3COONa
Если образовавшийся осадок растворить при нагревании, а затем охладить, то он снова выделяется, но уже в виде блестящих золотисто-желтых чешуек.
С катионом ртути (II) иодиды дают осадок оранжево-красного цвета, растворяющийся в избытке иодидов, с образованием бесцветного раствора:
HgCl2 + 2KI ® HgI2¯ + 2KCl
HgI2 + 2KI ® K2HgI4
При испытании на чистоту следует контролировать допустимые пределы содержания примесей катионов кальция, магния, бария, железа, мышьяка, тяжёлых металлов, а также бромат-, иодат-, цианид-, тиосульфат-, сульфит- и нитрат-ионов.
Примесь броматов в присутствии бромидов обнаруживают добавлением серной кислоты:
5KBr + KBrO3 + 3H2SO4 ® 3Br2 + 3K2SO4 + 3H2O
При наличии броматов появляется желтое окрашивание. Аналогично устанавливают примесь иодатов.
Примесь тиосульфат- и сульфит-ионов обнаруживают реакцией с раствором иода (в присутствии крахмала):
I2 + 2Na2S2O3 ® 2NaI + Na2S4O6
I2 + Na2SO3 + H2O ® Na2SO4 + 2HI
Синее окрашивание должно появляться после добавления не более одной капли 0,1 М раствора иода, что свидетельствует об отсутствии примеси указанных ионов.
Нитрат-ионы обнаруживают по реакции образования аммиака с цинковыми или железными опилками в щелочной среде:
Zn + 2NaOH + 2H2O ® Na2[Zn(OH)4] + H2
4H2 + NaNO3 ® NH3 + NaOH + 2H2O
Выделяющийся аммиак окрашивает (при наличии примеси нитратов) влажную красную лакмусовую бумагу в синий цвет.
Проводят также испытания на микробиологическую чистоту (ГФ XI, в.2, с.193)
Количественное определение галогенидов выполняют аргентометрическим методом. Лекарственные препараты хлоридов и бромидов титруют в нейтральной среде, в качестве индикатора используют хромат калия (метод Мора). Реакции протекают по схеме:
NaCl + AgNO3 ® AgCl¯ + NaNO3
NaBr + AgNO3 ® AgBr¯ + NaNO3
Избыток титранта (первая капля) взаимодействует с индикатором с образованием осадка оранжево-красного цвета, по которому устанавливают конечную точку титрования:
2AgNO3 + K2CrO4 ® Ag2CrO4¯ + 2KNO3
Иодиды определяют методом Фаянса в уксуснокислой среде, используя в качестве титранта 0,1 М раствор нитрата серебра и адсорбционный индикатор — эозинат натрия. После осаждения иодид-ионов образующиеся коллоидные частицы иодида серебра от добавления избытка ионов серебра становятся положительно заряженными:
Ag+
[AgI · I–] ¾¾® [AgI · Ag+]
Одновременно с приобретением положительного заряда коллоид [AgI × Ag+] притягивает отрицательно заряженный анион индикатора эозината натрия. В конечной точке титрования окраска поверхности коллоидных частиц (т.е. осадка) резко изменяется из желтой в розовую.
По МФ калия хлорид количественно определяют обратным аргентометрическим методом в среде дибутилфталата. Избыток 0,1 М раствора нитрата серебра оттитровывают 0,1 М раствором тиоцианата аммония, в присутствии индикатора аммоний-железо (III) сульфата (железоаммониевые квасцы). Калия иодид по МФ количественно определяют прямым аргентометрическим методом в присутствии смеси 50 мл раствора крахмала и 1 капли раствора иода в этаноле. Титруют до светло-желтого окрашивания.
С целью замены дорогостоящего нитрата серебра для количественного определения иодидов используют способ, основанный на окислении их до элементного иода. В качестве окислителя применяют 10%-ный раствор сульфата (II) меди в кислой среде. Выделившееся эквивалентное количество иода оттитровывают тиосульфатом натрия (индикатор крахмал).
Описан способ, основанный на окислении иодидов нитритом натрия (калия), позволяющий выполнять определение в присутствии хлоридов, бромидов и различных восстановителей:
2I– + 2NO2– + 4H+ ® I2 + 2NO + 2H2O
Известен также прямой меркуриметрический метод определения иодидов с использованием в качестве титранта 0,005 М раствора — перхлората ртути (II) Hg(ClO4)2, устойчивого при хранении. Индикатор дифенилкарбазон. Титруют в спирто-водной среде, исключающей выпадение осадка дииодида ртути.
Для количественного определения галогенидов можно использовать метод ионообменной хроматографии, с последующим алкалиметрическим завершением.
Натрия и калия хлориды хранят в сухом месте в плотно укупоренных банках. Бромиды и иодиды, кроме того, предохраняют от действия света (в склянках оранжевого цвета). Калиевые соли бромидов и иодидов отличаются меньшей гигроскопичностью. Они могут содержать лишь до 1% влаги, в то время как натриевые соли — до 4–5%.
Применение в медицинской практике лекарственных веществ хлоридов, бромидов, иодидов натрия и калия различно. Натрия хлорид — основная составная часть солевых и коллоидно-солевых растворов, применяемых в качестве плазмозамещающих жидкостей. Применяют также (наружно и внутривенно) гипертонические растворы натрия хлорида (3, 5 и 10%-ные) и изотонический (0,9%-ный) раствор натрия хлорида. Калия хлорид является антиаритмическим средством и источником ионов калия (при гипокалиемии). Он также входит в состав плазмозамещающих жидкостей. Натрия и калия бромиды применяют в качестве седативных (успокаивающих) средств внутрь и внутривенно. Выпускают их в виде ампулированных 5, 10 и 20%-ных растворов по 10 мл. Иодиды применяют при недостатке иода в организме (эндемическом зобе) и некоторых воспалительных заболеваниях.
11.2.3. Натрия фторид
В природе соединения фтора встречаются в виде минерала виллиомита, плавикового шпата (флюорита), криолита. Применяемый в медицине натрия фторид (табл. 11.5) получают спеканием флюорита с песком и карбонатом натрия:
CaF2 + SiO2 + Na2CO3 ® 2NaF + CaSiO3 + CO2
Затем выщелачивают водой при 50-55 °C.
Можно также получить натрия фторид нейтрализацией плавиковой кислоты.
11.5. Свойства натрия фторида
| Лекарственное вещество | Химическая формула | Описание |
| Sodium Fluoride (Natrii fluoridum)— натрия фторид | NaF | Белый порошок без запаха |
Натрия фторид растворим в воде, практически нерастворим в этаноле.
Подлинность устанавливают, обнаруживая катионы натрия по желтой окраске бесцветного пламени горелки и реакцией с цинкуранилацетатом. Фторид серебра в отличие от других галогенидов серебра растворим в воде. Наличие фторид-иона устанавливают по образованию плавиковой кислоты после добавления в свинцовый (платиновый) тигель 0,1 г натрия фторида и 1 мл концентрированной серной кислоты. Тигель покрывают прозрачным полированным стеклом и нагревают на водяной бане 15 мин. Поверхность стекла после промывания водой должна быть протравлена. Фторид-ион можно открыть реакцией осаждения по выделению из раствора натрия фторида белого осадка фторида кальция:
2NaF + CaCl2 ® CaF2¯ + 2NaCl
Фторид-ион можно обнаружить по исчезновению красного окрашивания тиоцианата железа (III), например:
[Fe(NCS)6]3– + 6F– ® 6NCS– + [FeF6]3–
Фторид-ион обнаруживают также с помощью 1%-ного спиртового раствора ализарина, который предварительно смешивают с 2%-ным раствором нитрата циркония в 5%-ной хлороводородной кислоте. Растворимые соли циркония образуют с ализарином комплексы красно-фиолетового цвета. При добавлении его к раствору, содержащему фторид-ионы, образуется растворимое комплексное соединение циркония с фтором. Окраска при этом из красно-фиолетовой переходит в жёлтую вследствие выделения свободного ализарина:

Количественно можно определить натрия фторид гравиметрическим методом после осаждения фторид-ионов хлоридом свинца:
NaF + PbCl2 ® PbFCl¯ + NaCl
При определении методом неводного титрования (по МФ) навеску натрия фторида кипятят 2 мин, растворив в уксусном ангидриде, с обратным холодильником. Затем охлаждают и титруют 0,1 М раствором хлорной кислоты (индикатор кристаллический фиолетовый):
2NaF + (CH3CO)2O + H2O ® H2F2 + 2CH3COONa
2CH3COONa + 2HClO4 ® 2CH3COOH + 2NaClO4
В таблетках натрия фторид (0,0022 г) определяют потенциометрическим методом с фторидным и хлорсеребряным электродами. Содержание натрия фторида рассчитывают по калибровочному графику.
Хранят в защищённом от света сухом месте, в хорошо укупоренной таре.
Фториды восполняют дефицит фтора в организме, способствуют укреплению зубной эмали, оказывают бактерицидное действие. Применяют натрия фторид в стоматологии (2%-ный раствор) и для профилактики зубного кариеса у детей в виде таблеток по 0,0005 г и таблеток для сосания по 0,001 г.
ГЛАВА 12.
|
Просмотров 4928 |
|
|
