
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

ШЕСТАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
|
|
Кислород
В промышленности кислород получают путем фракционного разделения предварительно сжиженного воздуха (метод низкотемпературной ректификации). Вначале испаряется азот (т. кип. -195,67 °C), а затем кислород (т. кип. –183 °C).
Другой промышленный способ заключается в электролизе воды. При этом одновременно получают кислород и водород. Электролизу подвергают водные растворы гидроксида натрия (16–18%-ные) или гидроксида калия (25–29%-ные) при 60–70 °C. Процесс проводят в электролитических ваннах, используя в качестве катода и анода специально обработанное мягкое железо:
KOH ® K+ + OH–
| Катод | Анод |
| 2H2O + 2e– ® H2 + 2OH– 2OH– + 2K+ ® 2KOH | 2OH– – 2e– ® 2OH 2OH ® H2O + 0,5O2 |
Прежде чем использовать кислород в медицинской практике, его подвергают очистке, пропуская через раствор щелочи, а затем через воду. Сухой кислород может вызвать раздражение слизистой оболочки дыхательных путей и легких.
Кислород включен в ГФ IX (табл. 12.1).
12.1. Свойства кислорода
| Лекарственное вещество | Химическая формула | Описание |
| Oxygenium— кислород | O2 | Бесцветный газ без запаха и вкуса, в 1,106 раз тяжелее воздуха. В жидком и твердом виде имеет бледно-синюю окраску. |
Кислород растворим приблизительно в 43 объемах воды и в 3,6 объемах этанола. Он энергично поддерживает горение, поэтому подлинность устанавливают по вспышке и яркому горению тлеющей лучинки, внесенной в сосуд с кислородом. Для отличия кислорода от другого газообразного препарата — азота закиси (диазота оксид) смешивают равные объемы кислорода и оксида азота. Смесь газов окрашивается в оранжево-красный цвет вследствие образования диоксида азота:
2NO + O2 ® 2NO2
Азота закись указанной реакции не дает. В процессе промышленного производства кислород может загрязняться примесями других в т.ч. токсических газов. Поэтому тщательно проверяют его чистоту. Во всех испытаниях на чистоту примесь других газов устанавливают, пропуская определенное количество кислорода (со скоростью 4 л/ч) через 100 мл раствора реактива.
Кислород должен быть нейтральным. Наличие в нем газообразных примесей кислотного и основного характера устанавливают колориметрическим методом по изменению окраски раствора индикатора — метилового красного.
Примесь оксида углерода (II) обнаруживают, пропуская кислород через аммиачный раствор нитрата серебра. Потемнение раствора свидетельствует о восстановлении серебра оксидом углерода:
CO + 2[Ag(NH3)2]NO3 + 2H2O ® 2Ag¯ + (NH4)2CO3 + 2NH4NO3
Наличие примеси диоксида углерода устанавливают по образованию опалесценции при пропускании кислорода через раствор гидроксида бария:
CO2 + Ba(OH)2 ® BaCO3¯ + H2O
Отсутствие примесей озона и других окисляющих веществ устанавливают, пропуская кислород через раствор иодида калия, к которому добавлен раствор крахмала и капля ледяной уксусной кислоты. Раствор должен оставаться бесцветным. Появление синей окраски свидетельствует о наличии примеси озона:
2KI + O3 + H2O ® I2 + 2KOH + O2
Все способы количественного определения кислорода основаны на взаимодействии с легко окисляющимися веществами. ГФ IX рекомендует для этого волюмометрический метод, выполняемый в газоанализаторах и основанный на изменении объёма анализируемой пробы после поглощения из неё кислорода. Кислород в приборе Гемпеля (ГФ IX, c. 350) пропускают через поглотительный медноаммиачный раствор, содержащий смесь хлорида аммония и аммиака. В нее помещают обрезки медной спиральной проволоки диаметром около 0,8 мм. Медь окисляется кислородом, а образующийся оксид меди (II) сразу же реагирует с компонентами, входящими в состав поглотительного раствора:
2Cu + O2 ® 2CuO
CuO + 2NH3 · H2О + 2NH4Cl ® [Cu(NH3)4]Cl2 + 3H2O
Содержание кислорода должно быть не менее 98,5% (1,5% составляет примесь азота и инертных газов).
В аптеках кислород хранят в баллонах объемом 27–50 л, вмещающих 4–7,5 м3 газа под давлением 10–15 МПА (100– 150 атм). Баллоны, содержащие кислород, окрашены в синий цвет. Резьбу редуктора баллона нельзя смазывать жиром или органическими маслами (возможна вспышка от воздействия струи кислорода). Смазкой служит только тальк. Кислород отпускают из аптек в специальных подушках, снабженных воронкообразным мундштуком для вдыхания.
Кислород применяют при заболеваниях, сопровождающихся кислородной недостаточностью. Назначают для вдыхания смесь 40–60% кислорода с воздухом. Используют также карбоген — смесь 95% кислорода и 5% диоксида углерода.
Вода
В фармацевтической практике используют воду очищенную, воду для инъекций и воду для инъекций в ампулах. Они имеют идентичные свойства, представляют собой бесцветные прозрачные жидкости без запаха и вкуса с pH 5,0–7,0, но различаются способами приготовления и, соответственно, степенью чистоты, что отражено в фармакопейных статьях (ФС).
Воду очищенную получают дистилляцией, ионным обменом, обратным осмосом или другим способом. Ее подвергают испытаниям на чистоту в соответствии с требованиями ФС. Определение pH (по ГФ XI, вып. 1, с. 114) проводят потенциометрическим методом. Сухой остаток не должен превышать 0,001%. Его устанавливают выпаривая досуха 100 мл воды. Затем высушивают при 100–105°C до постоянной массы, взвешивают и рассчитывают массовую долю (%).
Испытание на восстанавливающие вещества выполняют путем кипячения в течение 10 мин смеси, состоящей из 100 мл воды, 2 мл разведенной серной кислоты и 1 мл 0,01 М свежеприготовленного раствора перманганата калия. Должно сохраниться розовое окрашивание.
Содержание диоксида углерода контролируют по отсутствию помутнения в течение 1 ч у смеси, состоящей из равных объемов испытуемой и известковой воды (насыщенный раствор гидроксида кальция), в заполненном доверху и плотно закрытом сосуде.
Отсутствие нитратов и нитритов доказывают по отрицательной реакции с 1 мл 0,5% раствора дифениламина в концентрированной серной кислоте (не должно появляться голубое окрашивание). При выполнении испытания к 5 мл воды осторожно прибавляют указанный объем реактива.
Испытание воды очищенной на хлориды, сульфаты, соли кальция и тяжелые металлы выполняют в соответствии с требованиями ГФ XI (вып. 1, с. 165) «Испытания на чистоту и допустимые пределы примесей». Там же описано испытание на примесь аммиака, содержание которого допускается не более 0,00002%. Реагентом служит реактив Несслера. Контролируют также микробиологическую чистоту. Вода очищенная должна соответствовать требованиям, предъявляемым к питьевой воде (не более 100 микроорганизмов в 1 мл и не более трех бактерий группы кишечных палочек в 1 л воды). Химические реакции, происходящие при проведении перечисленных испытаний на чистоту и способы биологических методов контроля, описаны в части I учебника, в главе 6-й «Современные методы фармацевтического анализа».
Воду очищенную применяют для приготовления неинъекционных лекарственных средств. Ее используют свежеприготовленной или хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих от инородных частиц и микробиологических загрязнений.
В соответствии с инструкцией, утвержденной приказом Министерства здравоохранения РФ №214 от 16 июля 1997 г. «О контроле качества лекарственных средств, изготовляемых в аптеках», вода очищенная простерилизованная в течение 8 мин при 120 °C имеет срок годности 30 сут при 25 °C. Используют такую воду для приготовления микстур и растворов для внутреннего употребления, глазных капель и офтальмологических растворов, капель для носа, некоторых растворов для наружного применения и полуфабрикатов.
Вода для инъекций должна выдерживать испытания, приведенные в ФС «Вода очищенная» и быть апирогенной, не содержать антимикробных веществ и других добавок. Ее подвергают испытанию на пирогенность по требованиям соответствующей статьи ГФ XI (вып. 2, с. 183) и на механические включения.
Используют воду для инъекций свежеприготовленную или хранят при температуре от 5 до 10 °C или от 80 до 95 °C в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды, защищающих ее от попадания механических включений и микробиологических загрязнений, но не более 24 ч. На этикетках ёмкостей для сбора и хранения воды должно быть обозначено, что содержимое не простерилизовано.
Вода для инъекций используется в качестве растворителя для приготовления инъекционных растворов. Для инъекционных лекарственных форм, изготавливаемых в асептических условиях и не подвергаемых последующей стерилизации, применяют стерильную воду для инъекций.
Воду для инъекций в ампулах выпускают в ампулах из нейтрального стекла по 1, 2, 3, 5, 10, 20 мл, которые стерилизуют при 120 °C в течение 20 мин. ФС предъявляет более высокие требования к ее качеству. Вода для инъекций в ампулах не должна давать положительных реакций на хлориды, сульфаты, кальций, тяжелые металлы (ГФ XI, вып. 1, с. 165). Требования к рН среды, содержанию сухого остатка, восстанавливающих веществ, диоксида углерода, нитратов и нитритов, аммиака такие же, как и для воды очищенной.
Испытания на пирогенность и на наличие механических включений выполняют так же, как при испытании воды для инъекций. Кроме того устанавливают стерильность (ГФ XI, вып. 2, с. 187), проводят определение номинального объема и соблюдение других требований к ампулированным инъекционным растворам (ГФ XI, вып. 2, с. 140). Вода для инъекций в ампулах используется для тех же целей, что и вода для инъекций, но имеет срок годности четыре года.
12.3. Лекарственные препараты водорода перекиси*
По физическим свойствам различают жидкие (3%-ный раствор) и твердые (магния перекись, гидроперит) лекарственные препараты водорода перекиси. В ГФ включены раствор водорода перекиси и магния перекись, применяется также гидроперит (табл. 12.2).
12.2. Свойства лекарственных препаратов водорода перекиси
| Лекарственный препарат | Химическая формула | Описание | Содержание перекиси |
| Solutio Hydrogenii peroxydi diluta— раствор водорода перекиси | H2O2 | Бесцветная прозрачная жидкость без запаха | 3% H2O2 |
| Magnesii peroxydum— магния перекись | MgO2 + MgO | Белый легкий порошок, практически нерастворимый в воде | 25% MgO2 |
| Hydroperitum— гидроперит | 
| Белый кристаллический порошок, легко растворимый в воде, растворимый в этаноле, практически нерастворимый в хлороформе | 33–35% H2O2 |
Гидроперит образует водорода перекись при растворении в воде. Магния перекись выделяет водорода перекись в растворах минеральных кислот:
MgO2 + 2HCl ® MgCl2 + H2O2
Водорода перекись впервые получена Тенаром в 1818 г. при действии серной кислотой на бария перекись:
BaO2 + H2SO4 ® H2O2 + BaSO4¯
Производство водорода перекиси осуществляют электролизом 40–68%-ных растворов серной кислоты при 5–8 °C. Процесс электролиза проходит по схеме:
H2SO4 + H2O ® H3O+ + HSO4–
| Катод | Анод |
| 2H3O+ + 2e– ® 2H3O 2H3O ® 2H2O + H2 | 2HSO4– – 2e– ® 2HSO4 2HSO4 ® H2S2O8 |
Продуктом электролиза является надсерная (пероксодисерная) кислота.
При последующем нагревании раствора в вакууме (50 гПА или 38 мм рт. ст.) до 70–75 °C она разлагается с образованием водорода перекиси и серной кислоты:
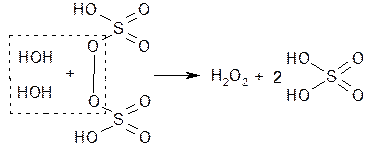
Эти способы позволяют получать разбавленные растворы водорода перекиси. Путем перегонки в вакууме при 70 °C концентрируют водорода перекись, получая в результате 30–60%-ные растворы.
В настоящее время свыше 80% мирового промышленного производства водорода перекиси осуществляют путем автоокисления воздухом таких производных алкилантрагидрохинонов как, например, 2-этил-, 2-трет-бутил, 2-пентилантрагидрохинонов:

Магния перекись можно получить при взаимодействии оксида магния с водорода перекисью:
MgO + H2O2 ® MgO2 + H2O
Процесс ведут при 7–8 °C до образования не менее 25% магния перекиси в смеси с 75% оксида магния. Затем промывают спиртом и высушивают в вакууме (»80гПА или 60 мм рт. ст.) при 45–50 °C. Получить лекарственный препарат можно также электролизом 20%-ного раствора хлорида магния и раствора водорода перекиси. Магния перекись выделяется на платиновом катоде. Еще один способ получения основан на окислении оксида магния кислородом при 500 °C:
2MgO + O2 ® 2MgO2
Гидроперит представляет собой сольват водорода перекиси. Его получают при взаимодействии эквимолекулярных количеств мочевины и водорода перекиси с добавлением раствора лимонной кислоты (консервант):

В химическом отношении водорода перекись представляет собой очень слабую кислоту. Водные растворы ее имеют слабокислую реакцию, константа диссоциации 2,0 · 10–12.
Водорода перекись проявляет как окислительные, так и восстановительные свойства. Она устойчива в чистом состоянии и в водных растворах (при обычной температуре). Однако присутствие примесей солей тяжелых металлов, диоксида марганца, следов щелочей, окислителей и восстановителей, даже попадание пылинок и соприкосновение с шероховатой поверхностью резко ускоряет процесс разложения водорода перекиси и может вызвать взрыв, если растворы имеют высокую концентрацию:
2H2O2 ® 2H2O + O2 + 188,55 кДж
Окислительные свойства водорода перекиси используют как для подтверждения подлинности, так и количественного определения. При установлении подлинности к 2 мл раствора водорода перекиси добавляют по 1 мл разведенной серной кислоты и иодида калия, а затем 5 мл хлороформа. Смесь взбалтывают, после расслоения образовавшийся в результате реакции свободный иод окрашивает слой хлороформа в фиолетовый цвет:
2I– + H2O2 + 2H+ ® I2 + 2H2O
Для установления подлинности указанных лекарственных препаратов водорода перекиси используют реакцию образования окрашенных в синий цвет перекисных соединений (смеси надхромовых кислот и пероксида хрома), растворимых в эфире. К раствору водорода перекиси, подкисленному серной кислотой, прибавляют диэтиловый эфир и несколько капель раствора дихромата калия. После взбалтывания и отстаивания смеси эфирный слой окрашивается в синий цвет:
K2Cr2O7 + H2SO4 ® H2Cr2O7 + K2SO4

При выполнении реакции с водорода перекисью высокой концентрации образуется надхромовая кислота состава H2Cr2O12:

Наряду с надхромовыми кислотами в результате реакции получается также пероксид хрома (VI):

Наличие иона магния в магния перекиси подтверждают по образованию белого кристаллического осадка фосфата магния-аммония при взаимодействии с раствором гидрофосфата динатрия в присутствии хлорида аммония и аммиака:
NH4Cl
MgCl2 + Na2HPO4 + NH3 ¾¾¾® NH4MgPO4¯ + 2NaCl
Мочевину в растворах гидроперита открывают с помощью биуретовой реакции. Это общая реакция на мочевину, амиды, имиды, полипептиды, белки. Биурет образуется при медленном нагревании мочевины до 150–160 °C. Вначале получается изоциановая кислота, которая реагирует с мочевиной, образуя биурет:
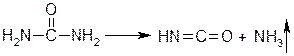

Взаимодействуя с солями меди (II) в щелочной среде, биурет образует растворимые внутрикомплексные соединения фиолетового цвета:

Наличие стабилизатора — цитрат-иона (лимонной кислоты) в гидроперите обнаруживают по реакции с раствором хлорида кальция. При нагревании после выделения газа выпадает осадок цитрата кальция, растворимый в хлороводородной кислоте.
Для количественной оценки твердых и жидких лекарственных препаратов используют либо восстановительные, либо окислительные свойства водорода перекиси.
Количественное определение водорода перекиси — восстановителя выполняют прямым перманганатометрическим титрованием в кислой среде (до слабо-розового окрашивания):
2KMnO4 + 5H2O2 + 3H2SO4 ® 2MnSO4 + K2SO4 + 8H2O + 5O2
Лекарственный препарат должен содержать 2,7–3,3% водорода перекиси.
Количественное содержание можно также установить, используя окислительные свойства водорода перекиси, иодометрическим методом:
2KI + H2O2 + H2SO4 ® I2 + K2SO4 + 2H2O
I2 + 2Na2S2O3 ® 2NaI + Na2S4O6
Количественное определение магния перекиси и водорода перекиси в гидроперите проводят прямым перманганатометрическим титрованием. Они должны соответственно содержать 25% магния перекиси и 35% водорода перекиси в гидроперите.
Хранят 3%-ный раствор водорода перекиси в склянках с притертыми стеклянными пробками, в прохладном защищенном от света месте. Концентрированные растворы водорода перекиси взрывоопасны. Твердые препараты водорода перекиси хранят в сухом, защищенном от света месте, в хорошо укупоренной таре при комнатной температуре. В присутствии влаги магния перекись образует гидраты: MgO2 · H2O и MgO2 · 2H2O.
Разложению водорода перекиси способствуют ферменты — каталаза, пероксидаза, содержащиеся в крови, слюне и других биологических жидкостях. Однако существует ряд ингибиторов этой реакции: фосфорная, щавелевая, лимонная, барбитуровая и мочевая кислоты, мочевина, барбитал, ацетанилид. Содержание ингибиторов определяют различными методами.
В соответствии с требованиями ФС раствор водорода перекиси должен в 100 мл содержать 10 г водорода перекиси (30%) и 0,05 г натрия бензоата (стабилизатора). Содержание последнего количественно определяют, титруя раствор водорода перекиси 0,05 М раствором хлороводородной кислоты (индикатор смесь метилового оранжевого и метиленового синего) в присутствии эфира, который извлекает образующуюся бензойную кислоту. В гидроперите титрованием 0,1 М раствором гидроксида натрия (индикатор фенолфталеин) определяют содержание стабилизатора — лимонной кислоты (0,15-0,25%).
Раствор водорода перекиси применяют в качестве антисептического, дезодорирующего и депигментирующего средства. Назначают для промываний, полосканий, предварительно разбавляя 3%-ный раствор водорода перекиси водой до 0,25%-ного. Одна таблетка гидроперита (1,5 г) соответствует 15 мл 3%-ного раствора водорода перекиси. Магния перекись применяют при желудочно-кишечных заболеваниях по 0,25– 0,5 г 3–4 раза в день.
Натрия тиосульфат
Натрия тиосульфат впервые получен в 1799 г. кипячением раствора сульфита натрия с серой:
Na2SO3 + S ® Na2S2O3
Окончание процесса устанавливают по отрицательной реакции на сульфит-ионы с раствором хлорида кальция (образование осадка CaSO3). Затем отфильтровывают избыток серы и сгущают фильтрат до кристаллизации. Выкристаллизовывается кристаллогидрат Na2S2O3 × 5H2O. Этот способ используют и в настоящее время. Получают натрия тиосульфат также путем сплавления его кальциевой соли с сульфатом натрия:
CaS2O3 + Na2SO4 ® Na2S2O3 + CaSO4¯
Лекарственное вещество натрия тиосульфат представляет собой пентагидрат (табл. 12.3).
12.3. Свойства натрия тиосульфата
| Лекарственное вещество | Химическая формула | Описание |
| Natrii thiosulfas— натрия тиосульфат | Na2S2O3 · 5H2O | Бесцветные прозрачные кристаллы без запаха |
Он очень легко растворим в воде, практически нерастворим в этаноле.
Проявляет восстановительные свойства. Сильные окислители (хлор) окисляют его до сульфата натрия, слабые (иод) — до тетратионата натрия.
Лекарственное вещество даёт характерные реакции на ион натрия. Тиосульфат-ион обнаруживают по обесцвечиванию раствора иода, а также по образованию опалесценции (вследствие выделения серы) и появлению запаха (диоксида серы) при добавлении хлороводородной кислоты:
Na2S2O3 + 2HCl ® SO2 + S¯ + 2NaCl + H2O
Обнаружению тиосульфат-иона мешают сульфит- и сульфид-ионы.
С избытком раствора нитрата серебра образуется белый осадок тиосульфата серебра, который быстро разлагается, осадок при этом желтеет, затем буреет и, наконец, становится черным (вследствие образования сульфида серебра):
Na2S2O3 + 2AgNO3 ® Ag2S2O3¯ + 2NaNO3
Ag2S2O3 ® Ag2SO3 + S¯
Ag2SO3 + S + H2O ® Ag2S¯ + H2SO4
Подлинность натрия тиосульфата можно подтвердить реакцией с хлоридом железа (III). Образуется фиолетового цвет тиосульфат железа (III), постепенно обесцвечивающийся вследствие восстановления до солей железа (II):
2FeCl3 + 3Na2S2O3 ® 6NaCl + Fe2(S2O3)3
Fe2(S2O3)3 ® FeS2O3 + FeS4O6
Для количественного определения используют окислительно-восстановительную реакцию натрия тиосульфата с иодом, подробно рассмотренную на примере определения лекарственных препаратов иода (см. ч. 2, гл. 11).
Поскольку натрия тиосульфат применяют в больших дозах, в том числе для внутривенного введения, его подвергают тщательному испытанию на чистоту. В соответствии с требованиями ФС устанавливают прозрачность и цветность 30%-ного раствора, щелочность 10%-ного раствора, допустимое количество примесей хлоридов, сульфидов, сульфитов и сульфатов, кальция, тяжелых металлов, железа, мышьяка и селена, а также испытывают на микробиологическую чистоту.
Натрия тиосульфат хранят в хорошо укупоренной таре. Следует учитывать, что в сухом теплом воздухе он выветривается, во влажном слегка расплывается, а при 50 °C плавится в кристаллизационной воде. Под действием света растворы натрия тиосульфата постепенно мутнеют из-за выделения серы.
Натрия тиосульфат применяют в качестве противотоксического и десенсибилизирующего средства. При отравлениях цианидами после приема внутрь натрия тиосульфата (20–30 мл 10%-ного раствора) образуются менее токсичные тиоцианаты:
KCN + Na2S2O3 ® KNCS + Na2SO3
При отравлении солями тяжелых металлов (ртути, мышьяка, таллия, свинца) под воздействием натрия тиосульфата образуются малорастворимые сульфиды. Иод восстанавливается до иодидов. При аллергических заболеваниях натрия тиосульфат вводят внутривенно в виде 10–30%-ных растворов.
ГЛАВА 13.
|
Просмотров 4651 |
|
|
