
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
|
|
Соединения бора
Наиболее важные минералы бора: борная кислота (сассолин) H3BO3; бура Na2B4O7 × 10H2O; кернит Na2B4O7 × 4H2O; борокальцит CaB4O7 × 4H2O; ашарит B2O3 × 2MgO × H2O и др.
В медицинской практике применяют лекарственные вещества кислоту борную и натрия тетраборат. Источниками их получения являются природные минералы, которые либо сами содержат борную кислоту (сассолин) и натрия тетраборат (бура, кернит), либо разрушаются с их образованием. Кислоту борную содержат термальные воды или природные рассолы, из которых её экстрагируют спиртами или адсорбируют сорбентами. Кислоту борную получают также разложением буры или борокальцита горячим раствором хлороводородной кислоты:
Na2B4O7 × 10H2O + 2HCl ® 4H3BO3 + 2NaCl + 5H2O
CaB4O7 × 4H2O + 2HCl + H2O ® 4H3BO3 + CaCl2
Фильтрат охлаждают, и выделившиеся кристаллы кислоты борной перекристаллизовывают из воды.
Натрия тетраборат получают действием растворов карбоната натрия (при нагревании) на кислоту борную или минерал борокальцит:
4H3BO3 + Na2CO3 ® Na2B4O7 + CO2 + 6H2O
CaB4O7 + Na2CO3 ® Na2B4O7 + CaCO3¯
При перекристаллизации натрия тетраборат присоединяет 10 молекул воды.
Кислота борная и натрия тетраборат представляют собой бесцветные вещества (табл. 15.1). Кристаллы кислоты борной жирные на ощупь, что является её отличительным признаком. Оба лекарственных вещества растворимы в воде и этаноле (1:25), медленно в глицерине (1:7). В кипящей воде их растворимость значительно улучшается. Кислота борная растворима в этаноле, а натрия тетраборат в нем практически нерастворим.
15.1. Свойства лекарственных веществ соединений бора
| Лекарственное вещество | Химическая формула | Описание |
| Acidum boricum— кислота борная | H3BO3 | Бесцветные, блестящие, жирные на ощупь чешуйки или мелкокристаллический порошок без запаха |
| Sodium Tetraborate (Natrii tetraboras)— натрия тетраборат (бура) | Na2B4O7 ·10H2O | Бесцветные, прозрачные, легко выветривающиеся кристаллы или белый кристаллический порошок |
Кислота борная возгоняется с парами воды и этанола. При нагревании кристаллов она постепенно теряет воду, образуя вначале (при 100°C) метаборную кислоту, затем стекловидную сплавленную массу (тетраборная кислота), которая при последующем прокаливании теряет воду, оставляя остаток оксида бора (III):

Водные растворы кислоты борной (1:50) имеют слабокислую реакцию (K = 6,4 × 10–10). В водной среде устанавливается равновесие:
H3BO3 + H2O ⇄ B(OH)4– + H+
При нейтрализации гидроксидами щелочных металлов образуются соли тетраборной кислоты H2B4O7 (тетрабораты) или реже метаборной HBO2 (метабораты). Соли ортоборной кислоты H3BO3 не известны. Растворы кислоты борной в глицерине в результате образования одноосновной комплексной диглицериноборной кислоты имеют более выраженную кислую реакцию (по сравнению с водным раствором борной кислоты):
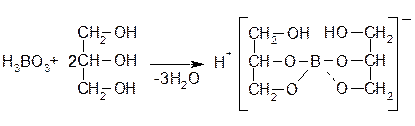
Водные растворы натрия тетрабората имеют щелочную реакцию (вследствие гидролиза):
Na2B4O7 + 7H2O ® 4H3BO3 + 2NaOH
Под действием сильных кислот происходит нейтрализация:
Na2B4O7 + 2HCl + 5H2O ® 4H3BO3 + 2NaCl
Эту реакцию используют для подготовки натрия тетрабората к испытанию на подлинность, а также для его количественного определения.
Подлинность соединений бора можно установить по реакции образования в присутствии этанола борноэтилового эфира:

Если затем смесь поджечь, она горит пламенем, окаймленным зеленым цветом.
Наиболее часто соединения бора идентифицируют с помощью куркумовой бумаги, которая от смачивания раствором кислоты борной (буры) и хлороводородной кислоты окрашивается при высушивании в розовый или буровато-красный цвет, переходящий после обработки раствором аммиака в зеленовато-черный. Установлено, что содержащееся в куркуме производное ацетилацетона — куркумин (диферулоилметан) в енольной форме взаимодействует с кислотой борной, образуя розоцианин — внутрикомплексное окрашенное соединение по типу эфира (И.М. Коренман):

В качестве реактивов для капельного обнаружения кислоты борной и натрия тетрабората могут быть использованы раствор кармина в концентрированной серной кислоте (фиолетовое окрашивание), раствор хинализарина в концентрированной серной кислоте (синее окрашивание), раствор ализаринового красного С в концентрированной серной кислоте (красное окрашивание), водный раствор пирокатехинового фиолетового в присутствии аммиачного буферного раствора (красное окрашивание). Раствор иода в присутствии разведенной хлороводородной кислоты и поливинилового спирта (или иодинола, его содержащего) приобретает синее окрашивание.
Для количественного определения соединений бора используют кислотные свойства растворов кислоты борной в глицерине и щелочные свойства водных растворов натрия тетрабората. При прямом титровании кислоты борной щелочью образуется метаборат натрия, который в водных растворах сильно гидролизуется:
H3BO3 + NaOH ® NaBO2 + 2H2O
NaBO2 + 2H2O ® H3BO3 + NaOH
В результате гидролиза щелочная реакция наступает до точки эквивалентности. Поэтому для количественного определения используют способность кислоты борной образовывать с глицерином сильную одноосновную диглицериноборную кислоту, которую можно с достаточной точностью оттитровать щелочью, используя в качестве индикатора фенолфталеин:

Количественное определение кислоты борной проводят в смеси (1:4) свежепрокипяченной воды (свободной от углекислого газа) и нейтрализованного (по фенолфталеину) глицерина при комнатной температуре. Для контроля полноты образования натриевой соли диглицериноборной кислоты к концу титрования добавляют дополнительную порцию (10 мл) глицерина. Сохранение при этом розовой окраски свидетельствует о достижении эквивалентной точки. Если окраска исчезает, вновь добавляют глицерин и титрование продолжают. Добавление глицерина продолжают до тех пор, пока розовая окраска не перестанет исчезать.
Количественное определение натрия тетрабората выполняют методом нейтрализации (индикатор метиловый оранжевый), используя для этого реакцию взаимодействия с хлороводородной кислотой:
Na2B4O7 · 10H2O + 2HCl ® 4H3BO3 + 2NaCl + 5H2O
Лекарственные препараты соединений бора хранят в защищённом от света месте, в хорошо укупоренной таре. Кислоту борную и натрия тетраборат применяют в качестве наружных антисептических средств в виде водных 1–4%-ных растворов.
Соединения алюминия
Из соединений алюминия в медицине чаще всего применяют алюминия гидроксид (табл. 15.2.)
Источниками получения алюминия и его солей являются минералы боксит, гиббсит (гидраргиллит), алунит и другие, представляющие собой смесь гидроксидов или их сочетание с сульфатом алюминия, оксидом кремния (IV).
Алюминия гидроксид получают из сульфата алюминия или квасцов и раствора аммиака:
Al2(SO4)3 + 6NH3 · H2О ® 2Al(OH)3¯ + 3(NH4)2SO4
2KAl(SO4)2 + 6NH3 · H2О ® 2Al(OH)3¯ + K2SO4 + 3(NH4)2SO4
Осаждают при температуре 60 °C в присутствии сульфата аммония. Осадок отфильтровывают, промывают горячей водой и высушивают при 40 °C.
Известны четыре кристаллические (a, b, g и g’) модификации и аморфный (гелеобразный) алюминия гидроксид переменного состава Al2O3 · nH2O.
По современным представлениям образование гидроксида алюминия происходит по схеме:
Al(H2O)63+ + H2O ® Al(H2O)5OH2+ + H3O+ (pKa1 = 4,96)
2Al(H2O)4(OH)+2 + nH2O ® Al2O3 × nH2O + 2H3O+
H3O+ + OH– ® 2H2O
Полное осаждение алюминия гидроксида достигается при pH » 5.
15.2. Свойства алюминия гидроксида
| Лекарственное вещество | Химическая формула | Описание |
| Aluminium Hydroxide (Aluminii Hydroxydum)— алюминия гидроксид | Al(OH)3 или Al2O3 · nH2O | Аморфный рыхлый белый порошок |
Алюминия гидроксид практически нерастворим в воде и этаноле, но растворим при нагревании в разведённых кислотах и растворах едких щелочей с образованием прозрачного или слабо мутного раствора:
Al(OH)3 + 3HCl ® AlCl3 + 3H2O
Al(OH)3 + NaOH ® Na[Al(OH)4]
Таким образом алюминия гидроксид является амфотерным соединением:
Al2O3 × nH2O + 6H+ ® 2Al3+ + (3+n)H2O
Al2O3 × nH2O + 2OH– ® Al(OH)4– + Al(OH)4(H2O)2+ + yH2O
Добавлением раствора хлорида аммония к щелочному раствору можно понизить pH раствора и осадить гидроксид алюминия:
2Al(OH)4– + NH4+ ® Al2O3 · nH2O¯ + NH3
Эту реакцию используют для испытания на подлинность. Если растворить при нагревании алюминия гидроксид в растворе гидроксида натрия, а затем к прозрачному раствору добавить хлорид аммония, то образуется белый студенистый осадок алюминия гидроксида.
Ион алюминия обнаруживают с помощью реакции пиролиза. Смоченное раствором нитрата кобальта небольшое количество алюминия гидроксида образует после прокаливания плав, окрашенный в синий цвет вследствие образования алюмината кобальта (тенаровой сини) — Co(AlO2)2.
В качестве реактивов на катион алюминия можно использовать также ализарин, образующий ализаринат алюминия (красное окрашивание); алюминон, образующий красный осадок; 8-оксихинолин — белый осадок.
Кроме испытаний на примеси хлоридов, сульфатов, солей аммония, тяжёлых металлов, мышьяка, МФ предусматривает установление нейтрализующей способности, суть которой состоит в определении количества 0,05 М хлороводородной кислоты, которое связывает 1,0 г алюминия гидроксида.
Количественное определение алюминия гидроксида выполняют комплексонометрическим методом, используя обратное титрование. Избыток ЭДТА Na оттитровывают 0,02 М раствором сульфата меди (индикатор мурексид).
Для количественного определения алюминия гидроксида может быть применён гравиметрический метод, основанный на предварительном прокаливании,охлаждении и взвешивании образовавшегося оксида алюминия:
t°
2Al(OH)3 ¾¾® Al2O3 + 3 H2O
Хранят алюминия гидроксид в хорошо укупоренной таре, применяют как антацидное средство.
Применяют в медицине также алюминия фосфат (Aluminium phosphate). Его получают из растворимых солей алюминия при взаимодействии с эквивалентными количествами ортофосфатов щелочных металлов в растворах с pH 4,0-4,5:
Al2(SO4)3 + 2Na3PO4 + nH2O ® 2AlPO4 · nH2O + 3Na2SO4
Выпадает аморфный осадок.
Применяют алюминия фосфат в виде геля в качестве противоязвенного, антацидного, обволакивающего, адсорбирующего средства. Механизм действия заключается в том, что в желудке в течение 10 мин pH повышается до 3,0-5,0 и снижается протеолитическая активность пепсина. Вторичная гиперсекреция не наступает, адсорбируются бактерии, вирусы, газы, эндо- и экзотоксины. Назначают при различных заболеваниях желудочно-кишечного тракта внутрь, через 1-2 часа после еды по 3-5 пакетиков на приём (один пакетик с 16 г геля содержит 10,4 г алюминия фосфата).
Гефал (Gefal) — лекарственный препарат, содержащий алюминия фосфат в виде суспензии (наполнители сахар, нипагин, нипазол) белого цвета, сладковатого вкуса, с запахом ароматической добавки. Выпускают во флаконах из полиэтилена по 250 г. Хранят в сухом прохладном месте. Замораживание не допускается. Применяют как антацидное средство при язвенной болезни, гастритах, диспепсии и др.
ГЛАВА 16.
|
Просмотров 5090 |
|
|
