
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Свойства и стандартизация сердечных гликозидов
|
|
Дигитоксин, дигоксин и строфантин К представляют собой белые или бесцветные кристаллические вещества, коргликон — порошок от светло-жёлтого до буровато-жёлтого цвета (табл. 48.5). Они мало растворимы или практически нерастворимы в воде.
48.5. Свойства лекарственных препаратов сердечных гликозидов
| Источник получения | Лекарственный препарат | Описание и растворимость |
| Листья ландыша майского (Convallaria majalis L.) и его разновидности семейства ландышевых (Convallariaceae) | Corglycon— коргликон (смесь гликозидов) | Порошок от светло-жёлтого до буровато-жёлтого цвета. Трудно растворим в воде, легко — в этаноле, практически нерастворим в эфире и хлороформе |
| Наперстянка пурпурная (Digitalis purpurea L.) и наперстянка шерстистая (Digitalis lanata Ehrh.) | Digitoxin— дигитоксин | Белый кристаллический порошок. Практически нерастворим в воде, мало растворим в этаноле, трудно — в хлороформе. Удельное вращение от +16 до +19 ° (1%-ный раствор в хлороформе) |
| Наперстянка шерстистая (Digitalis lanata Ehrh.), сем. норичниковых (Scrophulariaceae) | Digoxin— дигоксин | Белый кристаллический порошок. Практически нерастворим в воде, очень мало — в этаноле и хлороформе, растворим в метаноле |
| Семена строфанта комбе (Strophanthus kombe Oliver), сем. кутровых (Apocynaceae) | Strophanthin K— строфантин К (смесь гликозидов) | Белый или белый со слегка желтоватым оттенком порошок. Трудно растворим в воде и этаноле, практически нерастворим в эфире и хлороформе |
Объективную оценку подлинности сложных по химической структуре индивидуальных сердечных гликозидов позволяет сделать ИК-спектр, снятый после прессования в таблетках с бромидом калия в области 4000-400 см–1. Этот метод рекомендован ФС для дигоксина. Спектр должен быть идентичен спектру стандартного образца дигоксина, снятому в тех же условиях.
Для установления подлинности сердечных гликозидов могут быть использованы общие химические реакции. Первая группа цветных реакций позволяет обнаружить наличие стероидного цикла в молекуле, например реакция Либермана — Бурхардта. Она основана на способности стероидов к дегидратации под действием уксусного ангидрида и концентрированной серной кислоты. В результате реакции слой уксусного ангидрида окрашивается в зеленый цвет. ФС рекомендует эту реакцию для установления подлинности коргликона и строфантина К. Стероидный цикл в карденолидах обнаруживают флуориметрическим методом, используя в качестве реактива смесь фосфорной и серной кислот с хлоридом железа (III), раствор перхлората железа в серной кислоте и др. Реакции приемлемы тогда, когда анализируемый гликозид в результате дегидрирования образует окрашенные моно- или диангидридопроизводные. ФС рекомендует для обнаружения сердечных гликозидов в строфантине К реакцию с концентрированной серной кислотой (зеленое окрашивание).
Вторая группа цветных реакций основана на обнаружении пятичленного лактонного цикла с двойной связью в a,b-положении в молекуле карденолидов. К их числу относится реакция Легаля, суть которой заключается в образовании окрашенного в красный цвет продукта при взаимодействии сердечного гликозида с раствором нитропруссида натрия в щелочной среде. Эту реакцию ФС рекомендуют для испытания подлинности всех указанных лекарственных препаратов сердечных гликозидов. Пятичленный лактонный цикл можно также обнаружить по образованию окрашенных в красно-фиолетовый цвет продуктов взаимодействия с нитропроизводными ароматического ряда в щелочной среде, например, с м-динитробензолом (реакция Раймонда). Эту реакцию ФС рекомендует для обнаружения агликона в молекуле дигитоксина. Разновидностью данной группы реакций является образование окрашенных в оранжево-красный цвет продуктов взаимодействия сердечных гликозидов со щелочным раствором пикриновой кислоты (реакция Балье):

Третья группа реакций основана на обнаружении сахарного компонента в сердечных гликозидах. Для этой цели могут быть использованы свойственные сахарам реакции, основанные на их восстановительных свойствах (реакция с реактивом Фелинга, реакция «серебряного зеркала» и др.). Но наиболее широко применяют специфичную на 2-дезоксисахара (содержащиеся в молекулах большинства сердечных гликозидов) реакцию Келлера — Килиани. Из различных способов ФС рекомендует методику, заключающуюся в предварительном растворении 1–2 мг гликозида в ледяной уксусной кислоте, содержащей 0,05%-ного хлорида железа (III). Раствор осторожно вливают в пробирку с концентрированной серной кислотой и наблюдают окраску верхнего слоя, подтверждающую наличие в молекуле сахара — дигитоксозы (сине-зеленый цвет) и наличие агликона — дигитоксигенина по окраске на границе двух слоев (лилово-красной или бурой). Этим способом устанавливают подлинность дигитоксина.
Дезоксисахара можно обнаружить с помощью ксантгидрола (реакция Пезеца). При нагревании ксантгидрола (дибензо-g-пиранола) с испытуемым гликозидом в присутствии ледяной уксусной кислоты и последующем прибавлении нескольких капель серной или фосфорной кислоты появляется красное окрашивание. Аналогичную цветную реакцию дает антрон. Методика основана на образовании фурфурола или его производных из сахарных компонентов под действием концентрированной серной кислоты. Фурфурол с антроном затем дает продукт конденсации, окрашенный в зеленый или сине-зеленый цвет:

Подлинность сердечных гликозидов можно подтвердить по удельному вращению (табл. 48.5). Методом ТСХ устанавливают подлинность коргликона. На пластинке с закреплённым слоем силикагеля в смеси бензол-бутанол (1:1) разделяют компоненты, входящие в состав лекарственного препарата. После проявления м-динитробензолом должно быть не менее 5 пятен синего цвета, соответствующих конваллозиду, конваллятоксину, локундьезиду, конваллятоксолу и дезглюкохейротоксину. Для идентификации сердечных гликозидов и их агликонов перспективен способ, основанный на построении хроматографических диаграмм, которые выражают зависимость величин Rf от системы растворителей (В.П. Георгиевский с сотр.).
При испытании на чистоту лекарственных препаратов сердечных гликозидов определяют потерю в массе при высушивании, сульфатную золу и тяжёлые металлы, прозрачность и цветность растворов, но особое внимание следует обращать на наличие примеси посторонних гликозидов.
В соответствии с требованиями ФС в дигитоксине, гитоксине и строфантине К примеси других гликозидов устанавливают методом ТСХ на пластинках с закрепленным слоем силикагеля или с обращённой фазой. Хроматографируют восходящим методом в системе растворителей различного состава. Проявляют хлорамином Б или м-динитробензолом. О наличии примесей судят по совокупности величины и интенсивности окраски (флуоресценции) пятен в УФ-свете или значении их Rf. В дигитоксине устанавливают спектрофотометрическим методом по оптической плотности при длине волны 352 нм примеси гитоксина (не более 5%) и сапонинов (по реакции осаждения холестерином). В коргликоне по ФС устанавливают отсутствие примеси дубильных веществ (по отрицательной цветной реакции с ионом железа (III)) и сапонинов (по отсутствию стойкой пены после взбалтывания).
Применение спектрофотометрии для идентификации и количественного определения сердечных гликозидов оказалось возможным благодаря избирательному поглощению в УФ-области спектра (215–220 нм), обусловленному наличием в агликонах a, b-ненасыщенного лактонного цикла. Например, количественно определить дигитоксин можно при длине волны 215 и 219 нм.
Кроме того, сердечные гликозиды определяют в щелочной среде, фотометрируя окрашенные продукты их взаимодействия с нитропроизводными ароматического ряда. Значения молярных показателей поглощения образующихся окрашенных комплексов (чувствительность реакций) находятся в зависимости от химической структуры нитропроизводных: с 2,4-динитродифенилсульфоном 24600–24800, с пикриновой кислотой 14000–18800, с 3,5-динитробензойной кислотой 6000–9700. Наиболее широко применяют в качестве реактива пикриновую кислоту или пикрат натрия (реакция Балье) для определения дигитоксина, дигоксина, строфантина Г и др. Так, в соответствии с требованиями ФС для количественного определения коргликона, дигитоксина и строфантина К используют спектрофотометрию в видимой области спектра (495±1 нм). Измеряют оптическую плотность раствора образовавшегося пикрата относительно спиртового раствора пикриновой кислоты. Параллельно в тех же условиях получают и измеряют оптическую плотность пикрата стандартного образца. По нему рассчитывают содержание дигитоксина (95-105%). Содержание суммы сердечных гликозидов в строфантине К и коргликоне вычисляют по калибровочному графику. Строфантин К должен содержать не менее 80% гликозидов (в пересчёте на цимарин), а коргликон — 30-50% (в пересчёте на конваллятоксин).
Качественную и количественную оценку сердечных гликозидов выполняют также с помощью метода ВЭЖХ, отличающегося высокой чувствительностью и позволяющего определить не только основные, но и сопутствующие гликозиды, например в 0,05%-ном растворе строфантина К для инъекций. Этот метод дает результаты, сопоставимые с биологическим контролем. ФС на дигоксин рекомендует метод ВЭЖХ для установления подлинности по идентичности времени удерживания основного пика на хроматограммах растворов испытуемого и стандартного образцов. Количественное содержание дигоксина определяют с помощью жидкостного хроматографа со спектрофотометрическим детектором, при длине волны 220 нм. Содержание дигоксина вычисляют по измеренным площадям пиков испытуемого и стандартного образцов.
Биологическим методом активность устанавливают сравнением с препаратами-стандартами и выражают в ЛЕД (лягушачьих), КЕД (кошачьих) или ГЕД (голубиных) единицах действия. При биологическом методе контроля устанавливают наименьшие дозы стандартного и испытуемого лекарственного препарата, которые вызывают систолическую остановку сердца подопытных животных. Затем рассчитывают содержание единиц действия (ЕД) в 1,0 г исследуемого препарата, в одной таблетке или в 1 мл раствора (ГФ XI, вып. 2, с. 163). Этот метод ФС рекомендуют для оценки лекарственных препаратов, 1,0 г которых должен содержать строфантина К (43000-58000 ЛЕД или 5800-7100 КЕД, или 3827-4773 ГЕД), дигитоксина (8000-12000 ЛЕД или 1900-2400 ГЕД), коргликона (19000-27000 ЛЕД или 3030-3700 КЕД). Недостаток биологического контроля — трудоемкость, длительность и малая точность. Нередко его сочетают с применением физико-химических методов.
Ряд сердечных гликозидов и их лекарственных форм могут быть определены полярографическим методом. Достоинство этого метода заключается в том, что определение выполняется за счет восстановления двойной связи, сопряженной с карбонильной группой лактонного цикла. Эта система, как известно, является одним из факторов, обусловливающим биологическую активность сердечных гликозидов. Еще более широкие возможности достигаются при применении полярографии в сочетании с предварительным хроматографическим разделением.
Хранение и применение
Лекарственные препараты сердечных гликозидов хранят по списку А, в хорошо укупоренной таре, предохраняющей от действия света и влаги (коргликон — при температуре не выше +5 °C). Такие условия позволяют не допускать их гидролитического расщепления.
Большое влияние на стабильность гликозидов, особенно в растительном сырье, оказывают ферменты. Поэтому при его хранении и получении лекарственных веществ ферменты необходимо инактивировать. Это достигается путём высушивания сырья при 40-60 °C или обработки его парами этанола, эфира, хлороформа. После этого стабильность гликозидов значительно повышается.
Сердечные гликозиды, как правило, являются нейтральными соединениями. Они чувствительны к воздействию как кислот, так и щелочей. Под влиянием кислот, даже таких слабых, как уксусная, происходит отщепление легко гидролизуемых 2-дезоксисахаров, являющихся составными компонентами сердечных гликозидов. В щелочной среде происходит необратимая изомеризация карденолидов или расщепление лактонного цикла с образованием фармакологически неактивных соединений. Под влиянием щелочи в лактонном цикле может происходить перемещение двойной связи из a-b положения в b-g положение. Процесс гидролиза гликозидов сопровождается последовательным отщеплением моносахаридов, входящих в состав сахарного компонента. Установить стабильность сердечных гликозидов можно по отсутствию восстановительной способности, т.к. у них замещён полуацетальный гидроксил.
Сердечные гликозиды применяют в качестве кардиотонических средств при острой и хронической недостаточности кровообращения или сердечно-сосудистой недостаточности. Отличаются они по силе, продолжительности, скорости проявления действия, влиянию на центральную нервную систему.
Наиболее эффективны эти лекарственные препараты при внутривенном введении. Для этого их предварительно растворяют в 20–40%-ном растворе глюкозы или в изотоническом растворе до 0,025%-ной концентрации. Высшие разовые дозы индивидуальных сердечных гликозидов составляют 0,5 мг, суточные — 1,0 мг. Передозировка вызывает резкое нарушение сердечной деятельности. Это обусловило необходимость их включения в список А. Следует учитывать способность сердечных гликозидов постепенно накапливаться в организме (степень кумуляции).
ГЛАВА 49.
АНТИБИОТИКИ-ГЛИКОЗИДЫ
Стрептомицины
Стрептомицин — один из основных представителей антибиотиков-гликозидов. Большинство из них являются гликозидами с агликонами — производными аминоциклонолов и сахарными компонентами — аминосахарами.
Стрептомицин впервые описан в 1944 г. американским ученым З. Ваксманом, который, однако, отметил, что значительную роль в этом открытии сыграли исследования Н. А. Красильникова и других ученых в области изучения антагонизма актиномицетов и бактерий.
По химической структуре стрептомицин может быть рассмотрен как гликозид — N-метил-a-L-глюкозамидо-b-L-стрептозидо-стрептидин (табл. 49.1).
49.1. Свойства стрептомицина сульфата
| Лекарственное вещество | Химическая структура | Описание |
| Streptomycin Sulfate— стрептомицина сульфат | 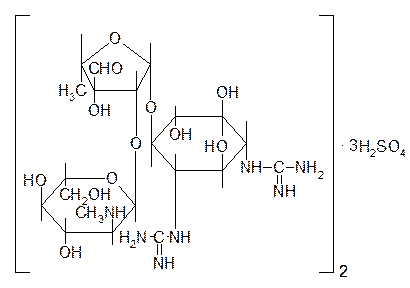
| Порошок белого или почти белого цвета без запаха. Гигроскопичен |
Агликон стрептомицина — стрептидин представляет собой 1,3-дигуанидино-2,4,5,6-тетраоксициклогексан или спирт — инозит, в котором две оксигруппы замещены остатками гуанидина:

Сахарная часть стрептомицина представляет дисахарид стрептобиозамин, построенный из связанных между собой остатков N-метил-L-глюкозамина и L-стрептозы:

Промышленными продуцентами стрептомицина служат штаммы актиномицетов Actinomyces streptomycini, Streptomyces griseus и др. Процессы ферментации осуществляют из наиболее активных штаммов, благоприятных сред и других условий, обеспечивающих максимальный выход антибиотика. Затем из культуральной жидкости сорбируют стрептомицин, многократно пропуская через катиониты и оксид алюминия.
Стрептомицин проявляет основные свойства ввиду наличия в молекуле азотсодержащих (двух гуанидиновых и одной N-метильной) групп. Поэтому он легко образует соли (сульфат, гидрохлорид) и комплексы с ионами некоторых двухзарядных металлов. Применяют в медицине стрептомицина сульфат (см. табл. 49.1). Это вещество белого цвета, легко растворимое в воде, практически нерастворимое в органических растворителях (этаноле, метаноле, эфире, хлороформе).
В слабокислой среде растворы стрептомицина устойчивы. Подобно другим гликозидам, он легко гидролизуется под действием сильных кислот с образованием стрептидина и стрептобиозамина. Стрептобиозамин затем распадается на N-метил-L-глюкозамин и L-стрептозу. Еще быстрее инактивируется стрептомицин в щелочной среде (на 50% в течение 3 ч под действием 0,1 М раствора гидроксида натрия). Однако при этом потеря активности обусловлена дегидратацией и изомеризацией L-стрептозы, которая превращается в мальтол (a-метил-b-окси-g-пирон):

Мальтол образуется значительно быстрее (в течение 4 мин), если стрептомицин нагревать с 0,5 М раствором гидроксида натрия на кипящей водяной бане. При взаимодействии с ионами железа (III) в кислой среде мальтол превращается в соединение, имеющее фиолетовую окраску. Эту цветную реакцию используют для испытания подлинности стрептомицина. Она может быть применена и для его фотометрического определения. Мальтольная проба обусловлена наличием альдегидной группы в молекуле стрептомицина.
Альдегидная группа, проявляя восстановительные свойства, обусловливает положительные реакции стрептомицина с реактивом Несслера (бурое окрашивание вследствие восстановления металлической ртути) и с реактивом Фелинга, который образует красный осадок восстановленного оксида меди (I). При конденсации альдегидной группы с фенолами (резорцином) после нагревания стрептомицина в присутствии концентрированной серной кислоты на кипящей водяной бане, появляется вишнево-красное окрашивание.
Остатки гуанидина в молекуле стрептомицина можно открыть по образованию фиолетово-красного окрашивания, которое возникает в щелочной среде под действием a-нафтола и гипобромида натрия. Происходит процесс окисления и бромирования a-нафтола с образованием имеющего хиноидный цикл нафтохинонимина:

Гуанидиновую часть молекулы можно идентифицировать в щелочной среде с помощью раствора нитропруссида натрия, подвергнутого воздействию ультрафиолетовых лучей или смесью растворов нитропруссида натрия и гексацианоферрата (III) калия. Появляется оранжево-вишневое окрашивание.
Гуанидин можно также обнаружить по выделению аммиака при нагревании со щелочью. При нагревании стрептомицина с диацетилом и оксидом кальция возникает оранжево-красное окрашивание.
Стрептомицина сульфат можно идентифицировать также по наличию сульфат-иона и по образованию пикрата стрептидина (т.пл. 283–284 °C). Вначале к раствору стрептомицина в метаноле добавляют концентрированной серной кислоты. Получают кристаллический сульфат стрептидина, который затем, действуя раствором пикриновой кислоты в горячей воде, превращают в пикрат.
ФС рекомендует для подтверждения подлинности стрептомицина сульфата использовать метод ТСХ. На пластинке со слоем силикагеля Н (содержащего карбомер) испытуемое вещество сравнивают с ГСО стрептомицина сульфата, неомицина сульфата и канамицина сульфата. В качестве проявителя используют нафталин-1,3-диол. Этим же методом определяют содержание примеси стрептомицина В (менее 3%).
Для установления подлинности стрептомицина сульфата, применяемого в качестве стандарта при биологическом контроле, используют ПМР-спектроскопию. Спектр ПМР должен соответствовать рисунку спектра, прилагаемому к ФС. Регистрируют спектр ПМР на ЯМР-спектрометре, устанавливая характерные сигналы при 1,26; 2,89; 3,31; 5,32; 5,57 и 5,07 м. д.
Методом ГЖХ устанавливают отсутствие примеси формальдегида.
Количественно стрептомицина сульфат определяют фотоколориметрическим методом, используя реакцию образования мальтола (не менее 90%). Светопоглощение измеряют в максимуме при 525 нм относительно смеси реактивов. Эта же химическая реакция лежит в основе цериметрического определения стрептомицина сульфата. Навеску растворяют в воде, добавляют 1 М раствор гидроксида натрия и кипятят на водяной бане 5 мин. После охлаждения и подкисления 1 М раствором серной кислоты добавляют 2%-ный раствор хлорида железа (III) и титруют 0,01 М раствором сульфата церия до исчезновения характерной красноватой окраски.
Биологическую активность стрептомицина сульфата устанавливают методом диффузии в агар с тест-микробом (ГФ XI, вып. 2, с. 210). Он должен содержать не менее 730 мкг/мл (ЕД/мл) в пересчете на сухое вещество (1 мкг химически чистого стрептомицина соответствует активности, равной 1 ЕД). Проводят также испытания на пирогенность, стерильность, токсичность, прозрачность, цветность и др.
Трилонометрическим методом определяют содержание сульфатов (18-21,5%) по связанному объёму 0,1М раствора бария хлорида (индикатор металлофталеин).
Стрептомицина сульфат хранят по списку Б, в сухом помещении (учитывая гигроскопичность), при температуре не выше 25°C. Упаковывают во флаконы, герметически закрытые резиновыми пробками, обжатыми алюминиевыми колпачками. В одном флаконе по 0,25, 0,5 и 1,0 г активного вещества в пересчете на стрептомицин основание, что соответствует 250 000, 500 000 и 1 000 000 ЕД.
Назначают главным образом для лечения различных форм туберкулеза, а также при заболеваниях, вызванных чувствительными к стрептомицинам бактериями (пневмонии, перитоните, гонорее, бруцеллезе и т. д.). Вводят внутримышечно по 0,5–1,0 г в сутки.
Антибиотики-аминогликозиды
Группа антибиотиков — канамицинов, продуцируемых лучистым грибом Streptomyces kanamiceticus, включает канамицин А, канамицин В и канамицин С. Наименьшую токсичность проявляет канамицин А, поэтому он составляет основную массу (94%) канамицина сульфата. В структуру канамицина А входит аглюкон 2-дезоксистрептамин (мезо-1,3-диамино-4,5,6-триоксициклогексан) и два остатка сахаров: 6-амино-6-дезокси-D-глюкоза (I) и 3-амино-3-дезокси-D-глюкоза (II).
Полусинтетическим аналогом, получаемым из канамицина А, является сходный с ним по химической структуре амикацин, который в виде сульфата применяется в медицинской практике. Основное его структурное отличие от канамицина заключается в наличии 4-амино-L-2-оксибутирильного радикала. Кроме того, вместо аглюкона 2-дезокси-D-стрептамина у амикацина в молекуле 2-дезокси-L-стрептамин:

С канамицином сходен антибиотик гентамицин — продукт жизнедеятельности Micromonospora purpurea. Он включает смесь трех антибиотиков — гентамицинов C1, C2 и C1a:

где C1 — R = CH3; R1 = CH3; C2 — R = CH3; R1 = H; C1a — R = H; R1 = H.
В медицинской практике применяют смесь сульфатов гентамицинов C1, C2, C1a под названием гентамицина сульфат.
По физическим свойствам антибиотики-гликозиды (табл. 49.2) представляют собой порошки белого, с желтоватым или кремоватым оттенком цвета, без запаха, гигроскопичные. Характерная их физическая константа — удельное вращение растворов.
49.2. Свойства антибиотиков-гликозидов
| Лекарственное вещество | Описание |
| Kanamycin Sulfate— канамицина сульфат | Белый кристаллический порошок, без запаха. Гигроскопичен. Удельное вращение от +103 до +115° (5%-ный водный раствор) |
| Gentamycin Sulfate— гентамицина сульфат | Белый порошок с кремоватым оттенком. Гигроскопичен. Удельное вращение от +107 до +121° (1%-ный водный раствор) |
| Amikacin Sulfate— амикацина сульфат | Аморфный порошок белого или белого с желтоватым оттенком цвета. Гигроскопичен. Удельное вращение от +74 до +84° (2%-ный водный раствор) |
Антибиотики-гликозиды легко или очень легко растворимы в воде, практически нерастворимы в этаноле, эфире, хлороформе.
Для испытания подлинности канамицина сульфата используют цветную реакцию со спиртовым раствором орцина и концентрированной хлороводородной кислотой в присутствии хлорида железа (III). При нагревании реакционной смеси в кипящей водяной бане образуется окрашенное в зеленый цвет вещество. Аналогичные результаты получаются, если вместо орцина использовать в качестве реактива 20% спиртовой раствор a-нафтола. Эти реакции обусловлены образованием фурфурола из сахаров. Амикацина сульфат можно обнаружить с помощью цветных реакций, в частности с антроном, по голубовато-фиолетовому окрашиванию. Если к водному раствору амикацина сульфата добавить раствор гидроксида натрия, а затем нитрата кобальта, то появляется фиолетовое окрашивание.
Присутствие аминосахаров в молекулах антибиотиков-аминогликозидов устанавливают цветной реакцией с 0,2%-ным раствором нингидрина в смеси бутанола и пиридина. При нагревании в течение 5 мин на водяной бане появляется фиолетовое окрашивание. После гидролиза в кислой среде канамицина сульфат дает положительные реакции на углеводы с аммиачным раствором нитрата серебра, реактивами Несслера и Фелинга.
Поскольку канамицина и гентамицина сульфаты являются смесями нескольких веществ, для испытания их подлинности используют метод ТСХ с закрепленным слоем сорбента. Хроматограмму канамицина проявляют нингидрином, а гентамицина — парами иода и сравнивают с хроматограммами стандартных образцов. Метод ТСХ на закрепленном слое силикагеля КСК №2 используют для установления подлинности амикацина сульфата (проявитель раствор нингидрина), а также для обнаружения в нем примеси канамицина.
ПМР-спектроскопию применяют для идентификации антибиотиков-аминогликозидов: неомицина В, мономицина А, канамицина А, тобрамицина, гентамицина и сизомицина. Наличие в слабых полях ПМР-спектров дублетных сигналов аномерных протонов углеводных фрагментов и сигналов, характерных для циклитолов, является общим для всей этой группы. Каждый из указанных антибиотиков имеет характерные сигналы поглощения, соответствующие определенным структурным фрагментам молекул. Однозначная связь спектральных параметров ПМР с химической и структурной природой молекул позволяет устанавливать подлинность каждого из антибиотиков в отсутствии образцов-свидетелей. Спектроскопию ЯМР 13C используют для идентификации стрептомицина, неомицина, мономицина, тобрамицина, канамицина А и его полусинтетического аналога — амикацина.
Компонентный состав гентамицина сульфата определяют методом ВЭЖХ по площадям пиков каждого компонента. Содержание гентамицина C1 должно быть 25-50%, C1a от 10 до 35%, суммы C2 и C2a — от 25 до 55%.
При испытании на чистоту в 33%-ных растворах антибиотиков в серной кислоте определяют на спектрофотометре светопоглощающие примеси при длине волны 400 нм (оптическая плотность не должна превышать 0,3). Методом ГЖХ определяют содержание остаточных растворителей в амикацина сульфате (этилового и пропилового спирта). Проводят также иные испытания, подтверждающие степень чистоты антибиотиков.
Биологическую активность (ГФ XI, вып. 2, с. 210) устанавливают методом диффузии в агар с тест-микробами; 1 мкг каждого химически чистого антибиотика соответствует специфической активности, равной 1 ЕД. В канамицина сульфате определяют также содержание канамицина В (не более 5% биологическим методом и не более 4% — методом ВЭЖХ).
Поскольку лекарственные препараты антибиотиков — гликозидов содержат связанную серную кислоту, они дают положительную реакцию на сульфат-ион. После осаждения хлоридом бария количественно определяют содержание сульфатов гравиметрическим или обратным трилонометрическим методом (индикатор металлфталеин). Для канамицина сульфата ФС рекомендует оба указанных метода.
Для количественного определения гентамицина сульфата применяют также нингидриновый и поляриметрический методы. Сопоставимые результаты с поляриметрическим анализом дает фотоколориметрический метод, основанный на образовании окрашенного комплекса гентамицина с солями меди в щелочной среде. Для фотометрического определения гентамицина используют цветную реакцию с салициловым альдегидом при рН 7,0. Образующееся при нагревании окрашенное салицилиденовое производное поглощает в области 405 нм.
Для количественной оценки антибиотиков-аминогликозидов используют и другие физико-химические методы, в частности спектрофотометрию, основанную на измерении поглощения продуктов превращения этих антибиотиков в дигидролутидиновые и другие производные. Разработана унифицированная методика спектрофотометрического количественного определения антибиотиков-аминогликозидов, основанная на образовании продуктов взаимодействия с азокрасителем кислотным хром сине-чёрным R (кальконом). Методика селективна и сопоставима с результатами микробиологического определения (А. В. Кукурека). Особенно широко для количественного экстракционно-фотометрического определения канамицина и гентамицина в лекарственных формах и биологических жидкостях применяют такие красители, как бромтимоловый синий, кислотный черный С и др.
Лекарственные препараты антибиотиков-аминогликозидов хранят по списку Б, в сухом, защищенном от света месте, в плотно укупоренной таре, при комнатной температуре.
Антибиотики-гликозиды обладают более широким спектром антибактериального действия, чем лекарственные препараты пенициллинов, тетрациклинов, левомицетинов. Назначают их внутрь и парентерально для лечения инфекционных заболеваний желудочно-кишечного тракта. Канамицина сульфат оказывает также бактерицидное действие в отношении микобактерий туберкулеза. Его назначают по 0,5-1,0 г для инъекций. Гентамицина сульфат назначают внутримышечно в виде 4%-ного водного раствора при лечении инфекционных заболеваний, в т. ч. кожи, костей, суставов, лёгких, мочевых путей. Одним из наиболее активных в этой группе является амикацина сульфат. Его назначают внутримышечно или внутривенно при сепсисе и других тяжёлых инфекциях мочевых и дыхательных путей. Выпускают в виде ампулированных растворов по 2 мл, содержащих 0,1 или 0,5 г амикацина сульфата.
|
Просмотров 9415 |
|
|
