
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Производные индолилалкиламинов
|
|
К числу индолилалкиламинов может быть отнесена большая группа производных индола: триптофан, серотонина адипинат, индометацин, суматриптан (имигран), трописетрон (набован), арбидол (табл. 56.1). Молекулы этих лекарственных веществ включают различные функциональные группы, которые обусловливают их физические и химические свойства.
Все указанные химические вещества (за исключением индометацина), являясь производными индола, содержат в молекуле также алкиламинные группы. Несмотря на отсутствие аминогруппы в молекуле индометацина, его структура очень сходна с триптофаном.
Триптофан и индометацин представляют собой органические кислоты, остальные являются солями органических оснований. Молекулы производных индолилалкиламинов включают алифатические радикалы, содержащие атомы серы (суматриптан и арбидол) или — сложноэфирные группы (трописетрон и арбидол).
Получают указанные лекарственные вещества синтетическим путем. Триптофан можно получить путем микробиологического или химического синтеза по схеме:
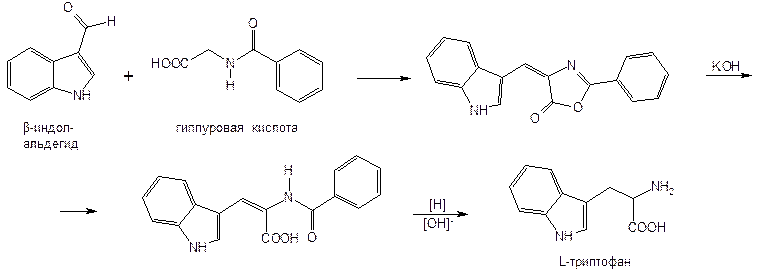
Из многочисленных способов синтеза серотонина наиболее экономичным является осуществляемый из триптофана путем введения гидроксигруппы в положение 5 и декарбоксилирования:
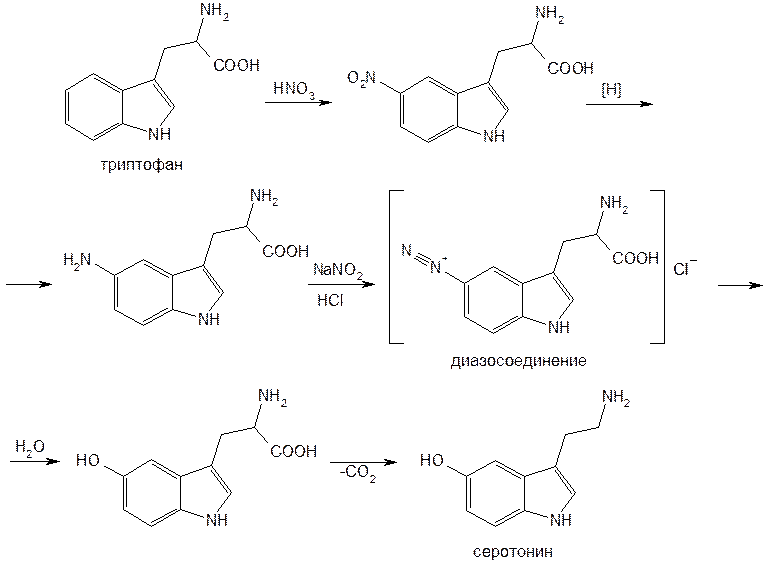
Действием адипиновой кислоты получают серотонина адипинат.
Синтез индометацина осуществляют конденсацией п-метоксифенилгидразина с метилатом 3-ацетилпропионовой кислоты. Образовавшийся эфир индолилуксусной кислоты гидролизуют и ацилируют п-хлорбензоилхлоридом:

56.1. Свойства производных индолилалкиламинов
| Лекарственное вещество | Химическая структура | Описание |
| L-Tryptophan— L-триптофан |  L-2-амино-3-индолилпропионовая кислота
L-2-амино-3-индолилпропионовая кислота
| Белый или слегка желтоватый кристаллический порошок или пластинки. Т. пл. 293-295 °C (с разложением). Удельное вращение от -30° до –32,5° (1%-ный водный раствор) |
| Serotonine Adipinate— серотонина адипинат |  5-окситриптамина адипинат
5-окситриптамина адипинат
| Белый или с кремоватым оттенком кристаллический порошок. Т. пл. 175-180 °C |
| Indometacin— индометацин |  1-(пара-хлорбензоил)-5-метокси-2-метилиндол-3-уксусная кислота
1-(пара-хлорбензоил)-5-метокси-2-метилиндол-3-уксусная кислота
| От белого до желтого цвета кристаллический порошок. Т. пл. 158-162 °C |
| Sumatriptan— суматриптан (Имигран) |  3-[2-(диметиламино)этил]-N-метилиндол-5-метансульфонамида сукцинат 3-[2-(диметиламино)этил]-N-метилиндол-5-метансульфонамида сукцинат
| Белый или не совсем белый кристаллический порошок |
| Tropisetron— трописетрон (Навобан) |  8-метил-8-азабицикло-[3,2,1]-окт-3a-иловый эфир-индол-3-карбоновой кислоты гидрохлорид
8-метил-8-азабицикло-[3,2,1]-окт-3a-иловый эфир-индол-3-карбоновой кислоты гидрохлорид
| От белого до белого с желтоватым или кремоватым оттенком кристаллический порошок |
| Arbidol— арбидол |  этилового эфира 6-бром-5-гидрокси-1-метил-4-диметиламинометил-2-фенилтиометил-индол-3-карбоновой кислоты гидрохлорид, моногидрат
этилового эфира 6-бром-5-гидрокси-1-метил-4-диметиламинометил-2-фенилтиометил-индол-3-карбоновой кислоты гидрохлорид, моногидрат
| От белого с зеленовато-желтым оттенком до светло-желтого с зеленоватым оттенком кристаллический порошок |
Производные индолилалкиламинов представляют собой белые кристаллические вещества, которые имеют желтый, кремовый или зеленоватый оттенок (табл. 56.1). В воде они практически нерастворимы (индометацин, арбидол), умеренно растворимы (триптофан) или растворимы (серотонина адипинат). Легко растворимы в воде трописетрон и суматриптан. Суматриптан растворим в физиологическом растворе. В этаноле производные индолилалкиламинов мало или умеренно растворимы. Индометацин умеренно растворим в хлороформе, эфире и растворах щелочей, арбидол — мало растворим в хлороформе. Триптофан и серотонина адипинат практически нерастворимы в эфире. Триптофан мало растворим в растворах хлороводородной кислоты. Трописетрон очень мало растворим в ацетоне.
Для испытания подлинности индолилалкиламинов используют ИК- и УФ-спектрофотометрию. Наиболее информативными являются ИК-спектры. ИК-спектр индометацина (МФ) должен соответствовать спектру стандартного образца или спектру сравнения этого лекарственного вещества. Таким испытанием подтверждают наличие соответствующей полиморфной формы. Трописетрон должен иметь в области 4000-400 см–1 ИК-спектр, идентичный рисунку спектра, прилагаемого к ФС.
УФ-спектр раствора индометацина в смеси 2М раствора хлороводородной кислоты и метанола (1:9) должен иметь один максимум при длине волны 318 нм (удельный показатель поглощения в пределах 170-190). Подлинность суматриптана подтверждают, проводя сравнительное измерение УФ-спектров растворов стандартного и испытуемого образцов в 0,1М хлороводородной кислоте в области 200-360 нм.
Водный раствор триптофана имеет максимум светопоглощения при 280 нм, а серотонина адипината в 0,01М растворе хлороводородной кислоты-максимумы при 220 и 275 нм. Раствор серотонина адипината в 0,1 М растворе гидроксида натрия имеет максимум при 322 нм (удельный показатель поглощения должен быть равен 120-130). При использовании в качестве растворителя концентрированной серной кислоты у серотонина адипината происходит батохромный сдвиг полос поглощения и максимум смещается в области 240 и 300-310 нм. Раствор арбидола в смеси этанола и хлороводородной кислоты в УФ-спектре, снятом в области 210-400 нм, имеет 3 максимума (при 224, 257 и 315 нм) и два минимума (при 244 и 284 нм) поглощения. УФ-спектр 0,002%-ного раствора трописетрона в 0,01 М спиртовом растворе хлороводородной кислоты в области 220-320 нм должен иметь максимум поглощения при 229 нм, широкий максимум в интервале 281-288 нм, два минимума при 223 и 260 нм и плечо в интервале 239-250 нм.
Для установления подлинности используют ряд химических реакций, характерных для аминокислот и для производных индола, а также реакций обнаружения атомов и функциональных групп. В отличие от индола и скатола, при нагревании до кипения с раствором иодноватой кислоты в присутствии триптофана выделяется иод. С бромной водой возникает розовое или фиолетовое окрашивание, переходящее от добавления пиридина в синее. С п-диметиламинобензальдегидом в присутствии 36%-ной хлороводородной кислоты и метанола триптофан приобретает красно-фиолетовое окрашивание, переходящее в темно-фиолетовое.
Для испытания триптофана на подлинность используют общую реакцию на аминокислоты с нингидрином (см. ч. I, гл. 6). После нагревания возникает сине-фиолетовое окрашивание. Серотонина адипинат в тех же условиях приобретает красное окрашивание. Аналогичное окрашивание возникает, если подействовать на него селенистой кислотой. Характерные цветные реакции дает серотонина адипинат под действием алифатических и ароматических альдегидов в присутствии концентрированной серной кислоты. Пурпурно-красное окрашивание возникает в присутствии формальдегида, ванилина, зеленое — под действием бензойного и салицилового альдегидов, синее — от п-диметиламинобензальдегида.
Серотонина адипинат под действием насыщенного раствора пикриновой кислоты образует оранжево-красный осадок пикрата. При добавлении диазореактива щелочной раствор серотонина адипината окрашивается в красно-коричневый цвет, т.к. образуется азокраситель:

Для выделения и обнаружения связанной с серотонином адипиновой кислоты к 10%-ному водному раствору прибавляют концентрированную хлороводородную кислоту. Выпавший через 10 минут осадок адипиновой кислоты после очистки и высушивания должен иметь температуру плавления 149-153 °C.
Арбидол дает цветную реакцию на наличие третичного азота. При нагревании над пламенем сухой смеси арбидола и лимонной кислоты с уксусным ангидридом возникает красно-коричневое окрашивание. После нагревания арбидола со смесью для спекания остаток растворяют в воде, фильтруют и выполняют реакции на бромиды и сульфаты, образовавшиеся за счёт наличия в молекуле арбидола атомов брома и серы:
Br– + Ag+ ¾® AgBr¯
SO42– + Ba2+ ¾® BaSO4¯
Фильтрат, полученный после встряхивания арбидола с раствором азотной кислоты, дает положительную реакцию на хлориды. Аналогичную реакцию дает трописетрон, применяемый в виде гидрохлорида. Трописетрон в капсулах идентифицируют методом ТСХ по значению Rf и интенсивности окраски основного пятна на хроматограммах испытуемого вещества и стандартного образца.
Для количественного определения производных индолилалкиламинов используют химические и физико-химические методы. Количественное определение триптофана, арбидола, трописетрона, серотонина адипината выполняют методом неводного титрования. В качестве растворителя используют ледяную уксусную кислоту (серотонина адипинат), ее смесь с муравьиной кислотой (триптофан), смесь уксусного ангидрида с муравьиной кислотой (арбидол), ледяную уксусную кислоту с раствором ацетата ртути (трописетрон). Титрантом во всех случаях служит 0,1 М раствор хлорной кислоты, индикатором — кристаллический фиолетовый. Для установления конечной точки титрования используют также потенциометрию.
Определить триптофан можно методом формольного титрования с помощью реакции используемой для количественного определения алифатических аминокислот (см.).
Индометацин, являющийся кислотой, можно определить методом нейтрализации. Навеску растворяют в ацетоне и титруют 0,1 М раствором гидроксида натрия (индикатор фенолфталеин). Параллельно выполняют контрольное титрование растворителей.
Триптофан количественно определяют спектрофотометрическим методом в максимуме поглощения при 280 нм.
В лекарственных формах (капсулах) индометацин определяют спектрофотометрическим методом при длине волны 318 нм, используя в качестве растворителя метанол. Расчеты ведут после измерения оптической плотности РСО индометацина.
Известен способ определения индометацина методом ВЭЖХ. Хроматографируют с использованием подвижной фазы: вода-смесь моно- и дизамещенного гидрофосфатов натрия в ацетонитриле (1:1). Детектируют при длине волны 254 нм, стандартный раствор — РСО индометацина.
Разработана унифицированная методика дифференциального спектрофотометрического определения производных индола (в т.ч. серотонина адипината) при длине волны 290 нм с использованием в качестве растворителя диметилформамида, а также способ фотоколориметрического определения на основе цветной реакции с п-диметиламинобензальдегидом.
Методом ВЭЖХ по совпадению времени удерживания стандартного и испытуемого растворов и их площадей пиков на хроматограммах подтверждают подлинность суматриптана в лекарственных формах. Метод ВЭЖХ применяют для количественного определения трописетрона в капсулах и суматриптана в таблетках. Определение выполняют на жидкостном хроматографе с УФ-детектором. Содержание суматриптана определяют, используя подвижную фазу, состоящую из ацетонитрила и фосфатного буферного раствора (с pH 6,0-8,0) в соотношении 20:80. Этим же методом устанавливают содержание примесей (не более 2%).
Хранят по списку Б индометацин, серотонина адипинат, арбидол, трописетрон. Триптофан, суматриптан, трописетрон хранят при температуре до +30 °C, индометацин — при комнатной температуре, в защищенном от света месте; серотонина адипинат — в склянках темного стекла, остальные — в хорошо укупоренной таре.
Триптофан в составе аминокислотных смесей применяют для парентерального питания (внутривенно). Индометацин — одно из наиболее активных нестероидных анальгезирующих и противовоспалительных средств. Применяют индометацин для лечения заболеваний, связанных с воспалительными процессами. Назначают внутрь в виде таблеток, капсул и драже по 0,025 г, суппозиториев по 0,05 г и 10%-ной мази. Серотонина адипинат — гемостатическое средство. Его применяют для лечения геморрагического синдрома, при различных формах анемии, тромбастении, для повышения стойкости капилляров. Вводят внутривенно и внутримышечно по 0,005-0,01 г в виде 1%-ного раствора. Суматриптана сукцинат — структурный аналог серотонина. Является специфическим антимигреневым средством. Купирует приступы мигрени и головные боли, уменьшает тошноту, рвоту, фотофобию. Трописетрон — противорвотное средство. Действие обусловлено избирательным блокированием периферических и центральных серотониновых рецепторов. Выпускают в виде капсул по 0,005 г и 0,1%-ного раствора в ампулах по 5 мл. Арбидол — противовирусное средство, ингибирует действие вирусов гриппа A и B, проявляет иммуномодулирующую активность и повышает устойчивость организма к вирусным инфекциям. Выпускают в таблетках по 0,1; 0,05 и 0,025 г.
Резерпин
В корнях индийского растения раувольфии змеиной (Rauwolfia serpentina Benth.), семейства кутровых — Apocynaceae, содержится около 40 различных алкалоидов. Некоторые из них обладают очень ценным седативным и гипотензивным действием (резерпин, ресциннамин), а другие (иохимбин, раувольфин, серпагин) вызывают адренолитический эффект.
Резерпин и сопутствующие ему алкалоиды — производные аллоиохимбана, основу химической структуры которого составляют индол (ядро AB), дегидрохинолизидин (CD) или гидрированный карболин (ABC).
Резерпин и некоторые другие алкалоиды раувольфии представляют собой сложные эфиры резерпиновой кислоты (или сходных с ней по химической структуре кислот):

Алкалоиды извлекают из измельченных корней эфиром в виде оснований после обработки раствором аммиака. Затем переводят в соли винной кислоты и вновь в основания. Разделение смеси алкалоидов производят с помощью адсорбционной хроматографии. Выделяют зону резерпина и извлекают алкалоид дихлорэтаном, а затем перекристаллизовывают из метанола.
Резерпин — двойной сложный эфир резерпиновой кислоты. При гидролизе образует метиловый спирт, триметоксибензойную и резерпиновую кислоты. Это является подтверждением химической структуры резерпина (табл.56.2).
56.2. Свойства резерпина
| Лекарственное вещество | Химическая структура | Описание |
| Reserрine— резерпин | 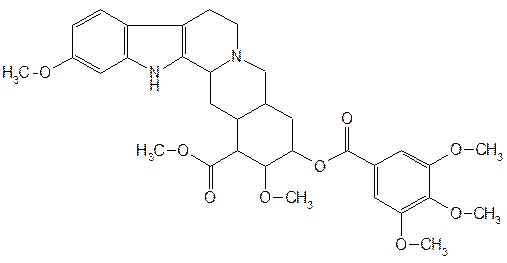 l-(11,17-диметокси-16-карбметокси-18-(3',4',5'-триметоксибензоил)-оксиаллоиохимбан l-(11,17-диметокси-16-карбметокси-18-(3',4',5'-триметоксибензоил)-оксиаллоиохимбан
| Белый или желтоватый мелкокристаллический порошок. Удельное вращение от –113 до –122° (1%-ный раствор в хлороформе) |
В медицине применяют левовращающий оптический изомер основания резерпина (см. табл. 56.2). Подобно другим основаниям, он очень мало растворим в воде и этаноле, но легко растворим в хлороформе и уксусной кислоте.
Подлинность (по МФ) подтверждают по ИК-спектру, который должен соответствовать спектру сравнения резерпина или его стандарта.
Установить подлинность резерпина можно с помощью спектрофотометрии в УФ-области. ФС регламентирует величину оптической плотности 0,002%-ного спиртового раствора в максимуме поглощения (268 нм) и в интервале длин волн 288–295 нм.
Для испытания резерпина используют реакции окисления и конденсации. Как и другие производные индола, резерпин легко окисляется с образованием окрашенных продуктов. Он дает цветные реакции с концентрированной серной (желтое), азотной (желтое, переходящее в кирпично-красное) кислотами, со смесью этих кислот (желто-зеленое), с реактивом Фреде (синее, переходящее в зеленое), реактивами Марки и Манделина (синее, при нагревании — зеленое). С пикриновой кислотой образует пикрат (т. пл. 186 °C).
Ряд цветных реакций дает резерпин с концентрированной серной кислотой в присутствии других реактивов. При добавлении реактива, состоящего из хлорида железа (III) и фосфорной кислоты, желтая окраска переходит в ярко-синюю. Если использовать в качестве реактива дихромат калия в присутствии концентрированной уксусной кислоты, то появляется ярко-зеленая окраска, переходящая в фиолетовую, а затем в красновато-коричневую. Окисление происходит при действии раствором нитрита натрия в кислой среде (зеленая флуоресценция):

Для выполнения цветных реакций могут быть использованы и другие окислители (перманганат калия, хлорная вода, пероксид водорода и др.). При окислении резерпина иодатом калия в уксуснокислой среде (после нагревания) происходит образование 3-дегидрорезерпина — окрашенного продукта, имеющего максимум светопоглощения в области 390 нм. Данную реакцию используют для идентификации и фотоколориметрического определения резерпина в лекарственных формах. Резерпин после нагревания со смесью разведенной уксусной кислоты и раствора иодида калия приобретает желтое окрашивание.
Окрашенные соединения резерпин образует, вступая в реакции конденсации с альдегидами. С раствором ванилина в хлороводородной кислоте он приобретает розовое окрашивание, а раствор n-диметиламинобензальдегида в присутствии ледяной уксусной и серной кислот вначале окрашивается в зеленый цвет, который после добавления избытка ледяной уксусной кислоты переходит в красный.
Количественное определение резерпина выполняют методом неводного титрования в среде ледяной уксусной кислоты. Учитывая, что резерпин образует гидрохлорид в эквимолекулярном соотношении (1:1), можно титровать резерпин также в спиртовой среде с помощью 0,1 М хлороводородной кислоты (индикатор метиловый красный):
C33H40O9N2 + HCl ¾® C33H40O9N2 × HCl
Известен также способ количественного определения резерпина фотометрическим методом. Способ основан на измерении светопоглощения при длине волны 390 нм окрашенного продукта взаимодействия резерпина с нитритом натрия в присутствии концентрированной серной кислоты. Расчеты выполняют относительно стандартного образца после взаимодействия с реактивом в тех же условиях.
Резерпин хранят по списку А, в хорошо укупоренных банках оранжевого стекла, в прохладном, защищенном от света месте. Он способен к изомеризации и окислению под действием света, воздуха, нагревания. Особенно легко окисляются растворы, в которых резерпин может также гидролизоваться.
Резерпин применяют в качестве нейролептического и гипотензивного средства. Назначают обычно внутрь по 0,0001–0,0003 г, иногда до 0,001–0,002 г в сутки для лечения гипертонической болезни и при нервно-психических расстройствах.
Производные карбазола
Карбазол (дибензопиррол) представляет собой гетероциклическую систему, включающую пиррол, конденсированный с двумя ядрами бензола:

Методы синтеза карбазола основаны на удалении атома серы из фенотиазина под действием меди или на циклизации дифениламина при пропускании через раскаленную трубку:

К числу синтетических производных карбазола может быть отнесен ондансетрон, содержащий также в молекуле остаток 2-метилимидазола (табл. 56.3). Ондансетрон сходен по химическому строению и фармакологическому действию с производным индола — трописетроном (см.).
Карбазол является структурной основой ряда алкалоидов, содержащихся в различных видах барвинка, экстракты из которого оказывают гипотензивное, сосудорасширяющее и седативное действие.
Девинкан (винкамин) — алкалоид, являющийся производным винкаминовой кислоты, содержится в надземной части двух видов растений: барвинка малого (Vinca minor L.) и барвинка прямого (Vinca erecta Rgl.), семейства кутровых (Apocynaceae). Он наряду с гипотензивным эффектом активно улучшает мозговое кровообращение, что послужило предпосылкой для создания его полусинтетического аналога — винпоцетина (кавинтона).
Винпоцетин (кавинтон) по химическому строению (табл. 56.3) отличается от девинкана тем, что представляет собой этиловый эфир аповинкаминовой кислоты. Он оказался более эффективным, чем девинкан, лекарственным веществом при лечении нарушений мозгового кровообращения.

56.3. Свойства производных карбазола
| Лекарственное вещество | Химическая структура | Описание |
| Ondansetron Hydrochloride— ондансетрона гидрохлорид (Зофран) |  4H-карбазол-4-он,1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1H-имидазол-1-ил)метила] гидрохлорид дигидрат 4H-карбазол-4-он,1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1H-имидазол-1-ил)метила] гидрохлорид дигидрат
| Белый или белый с кремоватым оттенком кристаллический порошок без запаха. Т. пл. 174-179 °C |
| Vinpocetine— винпоцетин (Кавинтон) |  этиловый эфир аповинкаминовой (3a,16a-эбурнаменин-14-карбоновой) кислоты
этиловый эфир аповинкаминовой (3a,16a-эбурнаменин-14-карбоновой) кислоты
| От белого до слегка желтоватого цвета кристаллы или кристаллический порошок без запаха. Т. пл. 149-153 °C. Удельное вращение от +127 до +134° (1%-ный раствор в диметилформамиде) |
Ондансетрона гидрохлорид и винпоцетин представляют собой кристаллические вещества белого или почти белого цвета (табл. 56.3). Они практически нерастворимы (винпоцетин) или умеренно растворимы (ондансетрона гидрохлорид) в воде, мало растворимы или растворимы в метаноле и этаноле. Ондансетрона гидрохлорид очень мало растворим в хлороформе, ацетоне и этилацетате; винпоцетин растворим в хлороформе и ледяной уксусной кислоте.
Испытания производных карбазола выполняют спектрофотометрическими, хроматографическими и химическими методами.
Подлинность ондансетрона гидрохлорида устанавливают сравнением ИК-спектров испытуемого вещества и стандартного образца, а также методом ВЭЖХ по времени удерживания и характеру основных пиков. Винпоцетин идентифицируют по ИК-спектру, снятому в диске из бромида калия. Он должен в области 4000-400 см–1 иметь полосы поглощения при 1720, 1607 и 1630 см–1.
УФ-спектр поглощения раствора ондансетрона гидрохлорида в этаноле в области 220-350 нм должен иметь максимумы поглощения при 246, 265 и 303 нм и минимумы поглощения при 231, 255 и 278 нм. УФ-спектр раствора винпоцетина в метаноле в области 190-400 нм должен иметь максимумы при 202, 229, 274 и 314 нм. Удельный показатель поглощения при длине волны 274,5 нм — от 330 до 343. Растворы винпоцетина в этаноле имеют максимумы при 227, 272 и 314 нм, а в 0,05М растворе хлороводородной кислоты — при 224, 269 и 314 нм.
Раствор винпоцетина в хлороводородной кислоте образует с реактивом Драгендорфа оранжевый осадок. Ондансетрона гидрохлорид дает положительную реакцию на хлориды и образует пикрат с пикриновой кислотой.
При испытании на чистоту остаточные растворители в винпоцетине (этанол и этилацетат) определяют методом капиллярной газожидкостной хроматографии с применением внутреннего стандарта. Посторонние примеси в ондансетрона гидрохлориде определяют методом ВЭЖХ по суммарной площади посторонних пиков (не более 0,5%).
Количественное определение производных карбазола выполняют методом неводного титрования с использованием в качестве титранта 0,1 М раствора хлорной кислоты (индикатор кристаллический фиолетовый). При титровании винпоцетина растворителем служит ледяная уксусная кислота, а ондансетрона гидрохлорида — смесь муравьиной кислоты и уксусного ангидрида (1:40).
Для количественного определения ондансетрона гидрохлорида применяют метод ВЭЖХ на хроматографах с УФ-детектором. Подвижной фазой служит смесь дигидрофосфата калия с 0,1 М гидроксидом натрия (до pH 5,4) и ацетонитрилом (50:50). Детектируют при длине волны 216 нм.
Количественное содержание винпоцетина и содержащихся в нем посторонних примесей (аповинкамин, этилвинкаминат) определяют методом ВЭЖХ с использованием обращеннофазовой колонки, по трем разделенным пикам основного вещества и его примесей.
Количественное определение винпоцетина в таблетках выполняют спектрофотометрическим методом при длине волны 314 нм (растворитель этанол). В качестве растворителя может быть также использован 0,05М раствор хлороводородной кислоты.
Хранят ондансетрона гидрохлорид и винпоцетин по списку Б, в защищенном от света месте при комнатной температуре, в плотно укупоренной таре.
Ондансетрона гидрохлорид относится к числу блокаторов периферических и центральных серотониновых рецепторов. Подобно трописетрону, он оказывает противорвотное действие. Применяют таблетки по 0,004 и 0,008 г и 0,2%-ный раствор в ампулах по 2 и 4 мл, в т.ч. при лечении хронического алкоголизма. Винпоцетин расширяет сосуды мозга и улучшает его снабжение кислородом, благодаря чему используется для лечения различных расстройств мозгового кровообращения. Выпускают таблетки винпоцетина по 0,005 г и 0,5%-ный раствор в ампулах по 2 мл.
|
Просмотров 11597 |
|
|
