
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Флавоноиды (витамины гpуппы P)
|
|
Витамины группы P имеют различную химическую структуру. Они содержатся во многих растениях, главным образом в плодах шиповника, цитрусовых, незрелых грецких орехах, ягодах черной смородины, рябине, зеленых листьях чая, винограде, гречихе и др.
К группе витаминов P относится большое число веществ — флавоноидов, которые распространены в природе либо в свободном состоянии, либо в виде гликозидов. По химическому строению флавоноиды представляют собой производные флавана (2-фенилхpомана), содержащего в молекуле конденсированную систему хpоман (дигидpобензо-g-пиpан) и связанное с ним бензольное ядро (в положении 2):

Из индивидуальных веществ, обладающих P-витаминной активностью, применяют рутозид (рутин), кверцетин, дигидрокверцетин (табл. 52.6). По химической структуре рутин относится к гликозидам. Сахарная часть его молекулы — дисахарид — включает D-глюкозу и L-рамнозу. Агликоном является кверцетин, который применяют в виде индивидуального лекарственного вещества с P-витаминной активностью. Дигидрокверцетин также является агликоном.
Рутин содержится в листьях руты пахучей (Ruta graveolens L.), в почках и цветках софоры японской (Sophora japonica L.) и других растений. Наиболее богатым его источником служит зеленая масса гречихи, из которой выделяют 1,5–6% рутина. Извлекают рутин водой, затем отделяют белки осаждением, и рутин перекристаллизовывают. При получении следует учитывать, что рутин в кислой среде, особенно при нагревании, легко гидролизуется с образованием кверцетина, рамнозы и глюкозы.
Кверцетин получают из рутина путём гидролиза. Дигидрокверцетин получают из древесины лиственницы сибирской (Larix sibirica Zedeb.) и лиственницы Гмелина (Larix gmelini Rupr.) или лиственницы даурской (Larix dahurica Furcz.), сем. сосновых (Pinaceae).
52.6. Свойства флавоноидов
| Лекарственное вещество | Химическая структура | Описание |
| Rutoside—рутозид (Рутин) | 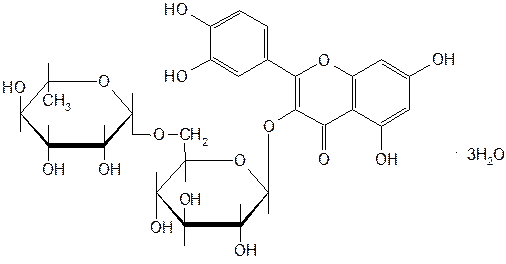 3-рутинозид кверцетина или
3-рамноглюкозил-3,5,7,3’,4’-пентаоксифлавон 3-рутинозид кверцетина или
3-рамноглюкозил-3,5,7,3’,4’-пентаоксифлавон
| Зеленовато-желтый мелкокристаллический порошок без запаха |
| Quercetin— кверцетин |  3,5,7,3’,4’-пентаоксифлавон
3,5,7,3’,4’-пентаоксифлавон
| Жёлтый мелкокристаллический порошок без запаха |
| Dihydroquercetin— дигидрокверцетин (Диквертин) |  2,3-дигидро-3,5,7,3’,4’-пентаоксифлавон
2,3-дигидро-3,5,7,3’,4’-пентаоксифлавон
| Мелкокристаллический или аморфный порошок от светло-желтого до желтого с зеленоватым оттенком цвета без запаха. Т.пл. 220-222 ºС |
Рутозид, кверцетин и дигидрокверцетин отличаются характерной зеленовато-желтой или желтой окраской кристаллов. Флавоноиды практически нерастворимы или очень мало растворимы (дигидрокверцетин) в воде и хлороформе, дигидрокверцетин растворим, кверцетин мало растворим в этаноле, а рутозид растворим в кипящем этаноле. Являясь многоатомными фенолами, они растворимы в разбавленных растворах едких щелочей.
Для испытания на подлинность флавоноидов используют ИК-, УФ-спектрофотометрию, ПМР-спектроскопию. ИК-спектры флавоноидов, полученные после прессования в таблетках бромида калия в области 4000-700 см–1, должны полностью совпадать с полосами поглощения прилагаемых к НД рисунков спектров.
УФ-спектры поглощения растворов флавоноидов в этаноле в области 220-400 нм имеют максимумы поглощения у рутозида при 258 нм и 362,5 нм, у кверцетина — при 255 нм и 375 нм, а у дигидрокверцетина — минимум поглощения при 247 нм, максимум при 290 нм и плечо при 325 нм. В соответствии с требованиями ФС устанавливают величины удельных показателей поглощения этанольных растворов. У рутозида при длине волны 362,5 нм он находится в пределах от 300 до 330; у дигидрокверцетина — при длине волны 290 нм он должен быть 630±60.
Подлинность дигидрокверцетина можно подтвердить с помощью ПМР спектров. Раствор в D4-метаноле должен иметь относительно тетраметилсилана химические сдвиги в виде дублетов 4,49; 4,90; 5,87; 5,91; 6,79; 6,84; 6,96 м.д., группу сигналов в области от 3,0 до 5,0 м.д., относящихся к растворителю, и должен соответствовать прилагаемому к ФС спектру ПМР. Подтверждением подлинности дигидрокверцетина служит также хроматограмма, полученная методом ВЭЖХ, на которой должен быть пик, сопоставимый с ГСО этого же вещества.
Для испытаний флавоноидов используют реакцию гидролиза (рутозид), а также химические реакции, обусловленные наличием в молекулах фенольных гидроксилов, образованием халконов, перилиевых солей, комплексных соединений.
Для испытания подлинности рутозида и кверцетина используют цветную реакцию с раствором гидроксида натрия (желто-оранжевое окрашивание). Окраска обусловлена превращением флавоноида в халкон с раскрытием пиранового цикла:

Цветная реакция происходит при действии на рутозид и кверцетин порошком магния и концентрированной хлороводородной кислотой в спиртовой среде (красное окрашивание). Это испытание известно под названием цианиновой реакции. Она основана на образовании окрашенных пирилиевых солей при восстановлении водородом флавоноидов, в том числе рутозида:

Для испытания на подлинность дигидрокверцетина (ФС) используют аналогичную реакцию, но вместо порошка магния берут гранулированный цинк; появляется малиновое окрашивание.
Наличие фенольных гидроксилов в молекуле рутозида и кверцетина легко установить цветной реакцией с хлоридом железа (III) (темно-зеленое окрашивание). При действии на спиртовый раствор рутозида 10% раствором молибдата аммония образуется комплексное соединение лимонно-желтого цвета с максимумом поглощения в области 380-390 нм.
Рутозид образует комплексные соединения с солями других тяжелых металлов, например с солями свинца (выпадает оранжевый осадок). Присутствие в его молекуле фенольного гидроксила обусловливает положительную реакцию с раствором формальдегида в серной кислоте (красно-оранжевое окрашивание) и реакцию образования азосоединения с солью диазония (красно-бурая окраска). Кверцетин образует азосоединение красно-оранжевого цвета. Окрашенные продукты получаются при взаимодействии рутозида и кверцетина с нитритом натрия в присутствии серной кислоты.
Подлинность рутозида подтверждают также путем кислотного гидролиза, который происходит в результате кипячения (с обратным холодильником) в присутствии серной кислоты. Образующийся кверцетин, перекристаллизованный из этанола, имеет температуру плавления 308 °C. Эту методику используют для гравиметрического определения рутозида.
Наличие глюкозы в молекуле рутозида обнаруживают после гидролиза в кислой среде с помощью реактива Фелинга.
При испытании на чистоту устанавливают наличие в рутозиде примеси кверцетина (не более 5%). Для этой цели используют УФ-спектрофотометрию или радиальную бумажную хроматографию. Хроматографируют в чашке Петри в 60%-ном растворе уксусной кислоты. После опрыскивания 10%-ным раствором сульфата аммония хроматограммы сушат и просматривают в УФ-свете при 360 нм. Должно быть только одно пятно кверцетина. Устанавливают также отсутствие в рутозиде примеси алкалоидов, хлорофилла и пигментов, растворимых в эфире, а также других примесей, нерастворимых в этаноле. Они могут попасть в него из исходного растительного сырья.
В кверцетине устанавливают наличие примеси посторонних флавоноидов методом ТСХ на пластинках Силуфол или Сорбфил в системе растворителей хлороформ-метанол-вода (52:28:6). В УФ-свете при длинах волн 254 и 366 нм на хроматограмме должно просматриваться одно пятно с Rf 0,6±0,1. Родственные примеси (кверцетина, дигидрокемпферола, нарингенина) в дигидрокверцетине определяют методом ВЭЖХ с помощью жидкостного хроматографа с УФ-детектором и колонкой с обращенно-фазным сорбентом в условиях, предусмотренных ФС. Их общее содержание не должно превышать 10%. Этот же метод используют для количественного определения дигидрокверцетина (не менее 90%). Содержание рассчитывают по площадям пиков испытуемого вещества и ГСО.
Количественное определение рутозида и кверцетина выполняют методом УФ-спектрофотометрии. Растворителем служит абсолютный этанол для рутозида и смесь этанола, хлороводородной кислоты и воды (2:1:47) для кверцетина. Измерения оптической плотности растворов рутозида выполняют при 375 и 362,5 нм, а затем рассчитывают содержание по приведенным в ФС формулам. Содержание кверцетина вычисляют по величине оптической плотности ГСО. Известны также различные способы фотометрического определения рутозида и кверцетина с использованием рассмотренных выше цветных реакций.
Рутозид, кверцетин и дигидрокверцетин хранят в хорошо укупоренной таре, в сухом месте, предохраняя от действия света.
Они относятся к группе капилляроукрепляющих средств. Применяют внутрь для профилактики и лечения гипо- и авитаминоза P, а также для лечения заболеваний, связанных с нарушением проницаемости сосудов и поражений капилляров. Назначают рутозид внутрь в виде таблеток по 0,02–0,05 г 2–3 раза в сутки. Аналогично рутозиду, но в несколько меньших дозах (по 0,02 г) назначают кверцетин и дигидрокверцетин.
ГЛАВА 53.
ПРОИЗВОДНЫЕ ТИОФЕНА
В 80-90-х годах XX века было синтезировано большое число соединений, содержащих в молекуле частично или полностью гидрированный пиридин, его конденсированную систему с тиофеном (тиенопиридин), а также ароматический компонент (о-хлорфенил, остаток тирозина или аланина). Эти соединения проявляют антиагрегантные свойства.
Одним из таких лекарственных веществ является соединение, включающее гетероциклы тиофен и пиридин, производное тетрагидротиенопиридина — тиклопидина гидрохлорид (табл. 53.1).

53.1. Свойства тиклопидина гидрохлорида
| Лекарственное вещество | Химическая структура | Описание |
| Ticlopidine Нydrochloride— тиклопидина гидрохлорид (Тиклид) |  5-[(2-хлорфенил)метил]-4,5,6,7-тетрагидротиено[3,2c]пиридин
5-[(2-хлорфенил)метил]-4,5,6,7-тетрагидротиено[3,2c]пиридин
| Белое кристаллическое вещество |
Тиклопидина гидрохлорид легко растворим в воде и метаноле, умеренно растворим в этаноле и метиленхлориде, трудно растворим в ацетоне.
Подлинность тиклопидина гидрохлорида устанавливают методом УФ-спектрофотометрии. Испытуемый раствор в области 250-350 нм имеет два максимума поглощения при 268 и 275 нм.
Для испытания подлинности используют также цветную реакцию с 2% раствором лимонной кислоты в уксусном ангидриде. При нагревании смеси на водяной бане до 80 °C появляется красное окрашивание. Подтвердить подлинность можно также методом ВЭЖХ (при проведении количественного определения). Время удерживания пика испытуемого и стандартного растворов должно быть идентичным.
Посторонние примеси определяют методом ТСХ (не более 0,4%), а остаточные количества растворителей (метиленхлорида и изопропилового спирта) — методом ГЖХ.
Метод ВЭЖХ используют для обнаружения примесей, в т.ч. N-(2-хлорбензил)-2-(2-тиенил)этиламин гидрохлорида (не более 0,2%). Подвижной фазой служит смесь метанол-0,005М раствор гидрофосфата калия (70:30). Этот же метод используют для количественного определения тиклопидина гидрохлорида в таблетках с использованием в качестве подвижной фазы смеси ацетонитрила и фосфатного буферного раствора (60:40).
Количественное определение тиклопидина гидрохлорида выполняют также методом неводного титрования, а в таблетках — спектрофотометрическим методом при 232 нм (перегиб в УФ-спектре), используя растворитель 0,01М раствор хлороводородной кислоты.
Хранят тиклопидина гидрохлорид по списку Б в прохладном, сухом, защищенном от света и влаги месте, при температуре до 25 °C.
Тиклопидина гидрохлорид проявляет избирательное антитромботическое действие. Применяют для профилактики тромбозов, в т.ч. после инфарктов, при тяжелом атеросклерозе и ишемических заболеваниях внутрь в таблетках по 0,25 г. Снижает риск повторных инфарктов и инсультов.
ГЛАВА 54.
ПРОИЗВОДНЫЕ ПИРРОЛИДИНА
Производные 2-пирролидона
Пиррол — пятичленный гетероцикл с одним гетероатомом азота, пирролидин — гидрированный пиррол. Применяемые в медицине производные пиррола представляют собой соединения пирролидина и 2-оксопирролидина (2-пирролидона):

В результате поиска структурных аналогов g-аминомасляной кислоты (ГАМК), обладающих психотропным действием, получен пирацетам (ноотропил). Он представляет собой циклический аналог ГАМК — 2–(2-оксо-1-пирролидинил)ацетамид:

Исходным продуктом синтеза пирацетама является a-пирролидон. Поскольку он с трудом алкилируется по атому азота, синтез осуществляют через его лактимный эфир:

Пирацетам является родоначальником новой группы психотропных лекарственных веществ, названных «ноотропами».
54.1. Свойства пирацетама
| Лекарственное вещество | Химическая структура | Описание |
| Piracetam— пирацетам (Ноотропил) |  2-(2-оксо-1-пирролидинил)ацетамид
2-(2-оксо-1-пирролидинил)ацетамид
| Белый кристаллический порошок без запаха. Т.пл. 151–155 °C |
Пирацетам (табл. 54.1) легко растворим в воде, растворим в этаноле, мало растворим в хлороформе, практически нерастворим в эфире.
Подлинность пирацетама устанавливают с помощью ИК-спектра, снятого после прессования в таблетках с калия бромидом в области 4000-400 см–1, по полному совпадению полос поглощения с прилагаемым к ФС рисунком спектра. Кроме того, подлинность подтверждают по отсутствию выраженных максимумов поглощения в УФ-спектре 1%-ного водного раствора в интервале 230-350 нм.
При нагревании пирацетама с раствором гидроксида натрия выделяется аммиак, который обнаруживают по запаху и посинению красной лакмусовой бумаги. Эта же химическая реакция лежит в основе количественного определения пирацетама по методу Кьельдаля (см. ч. I, гл. 6).
Посторонние примеси (не более 0,5%) определяют методом ТСХ на пластинке со слоем силикагеля вместе со свидетелем (растворы в метаноле). Хроматографируют восходящим методом в камере со смесью растворителей хлороформ-метанол-раствор аммиака концентрированный (70:30:3). Проявляют в камере для хлорирования смесью 1,5%-ного раствора перманганата калия и хлороводородной кислоты концентрированной (1:1). При испытании на чистоту определяют также прозрачность, цветность, pH раствора, сульфатную золу, тяжелые металлы и микробиологическую чистоту (методом прямого посева).
Для идентификации и фотометрического определения пирацетама в лекарственных формах используют цветную реакцию, основанную на образовании индофенола. Методика состоит в последовательной обработке пирацетама гипохлоритом натрия и фенолом с последующим фотометрированием окрашенного раствора при 630 нм.
Хранят по списку Б в сухом, защищенном от света месте.
Применяют пирацетам как психотропное (ноотропное) средство при заболеваниях нервной системы, особенно связанных с нарушением обменных процессов мозга и с сосудистыми заболеваниями. Назначают в таблетках (капсулах) по 0,4-0,8 г или 20%-ные растворы в ампулах для инъекций.
Производные пролина
В 80-х годах XX века были созданы синтетические ингибиторы ангиотензинконвертирующего фермента, обладающие антигипертензивным действием. Наиболее широкое применение из них сразу же получили производные пирролидина: каптоприл и эналаприл.
Основой химической структуры каптоприла и эналаприла является производное аминокислоты пролина — 2-метилпропионил-L-пролин:

Каптоприл — первый синтетический серусодержащий ингибитор ангиотензинконвертирующего фермента, основной представитель этой группы. Эналаприл отличается от каптоприла более сложной химической структурой и отсутствием в молекуле меркаптогруппы (табл. 52.2). Он является «пролекарством», т.к. в организме гидролизуется до каптоприла, ингибирующего ангиотензинконвертирующий фермент.
Исходными продуктами синтеза каптоприла являются тиоуксусная и метакриловая кислоты. Они образуют тиоэфир, который превращают в хлорангидрид, или ацилируют пролин и полученное N-ацилпроизводное гидролизуют:

54.2. Свойства производных пролина
| Лекарственное вещество | Химическая структура | Описание |
| Captopril— каптоприл (Капотен) |  1-[(2S)-3-меркапто-2-метилпропионил]-L-пролин
1-[(2S)-3-меркапто-2-метилпропионил]-L-пролин
| Белый кристаллический порошок с характерным запахом |
| Enalapril Maleate— эналаприла малеат |  1-[N-[S]-1-карбокси-3-фенилпропил]-L-аланил-L-пролин-1’-этилового эфира малеат
1-[N-[S]-1-карбокси-3-фенилпропил]-L-аланил-L-пролин-1’-этилового эфира малеат
| Белый кристаллический порошок |
Производные пролина представляют собой белые кристаллические вещества (табл. 54.2). Каптоприл легко растворим в воде, этаноле, метаноле, хлороформе. Эналаприл умеренно растворим в воде, растворим в этаноле, метаноле, диметилформамиде.
Фармакопея США рекомендует для испытания их подлинности использовать ИК-спектры, которые должны соответствовать спектрам стандартных образцов.
Каптоприл и эналаприл идентифицируют методом ВЭЖХ по временам удерживания основных пиков. Каптоприл идентифицируют также методом ТСХ на пластинках Силуфол или Сорбфил УФ-254 параллельно со свидетелем в системе толуол-ледяная уксусная кислота (3:1). Методом ВЭЖХ определяют примесь каптоприла дисульфида (по параметрам пиков примеси и испытуемого вещества).
Каптоприл можно количественно определить иодатометрическим методом. Точную навеску (около 0,3 г) растворяют в 100 мл воды в колбе с притертой пробкой, добавляют 10 мл 3,6 М серной кислоты и 1,0 г иодида калия, 2 мл раствора крахмала. Титруют 0,1 М раствором иодата калия до появления голубой окраски, не исчезающей в течение 30 сек. Определение основано на окислении сульфгидрильной группы иодом:
KIO3 + 5KI + 3H2SO4 ¾® 3I2 + 3K2SO4 + 3H2O
2R-SH + I2 ¾® R-S-S-R + 2HI
Количественное определение каптоприла в таблетках выполняют методом УФ-спектрофотометрии при длине волны 212 нм (растворитель — 0,1М раствор хлороводородной кислоты). Эналаприла малеат в таблетках определяют методом ВЭЖХ.
Хранят каптоприл и эналаприл по списку Б, в сухом, защищенном от света месте, в плотно укупоренной таре; каптоприл — при температуре не выше 30 °C.
Каптоприл и эналаприл обладают гипотензивным действием. Их назначают при различных формах гипертонической болезни и сердечной недостаточности внутрь в таблетках — каптоприл по 0,025; 0,05 и 0,1 г; эналаприл — по 0,005; 0,01 и 0,02 г.
|
Просмотров 10260 |
|
|
