
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Галоидпроизводные ароматических углеводородов
|
|
Классификация, изомерия, номенклатура
Различают два вида галогенопроизводных ароматических углеводородов.
1.Вид соединения галогена с углеродом ароматического кольца
а) Моногалогенопроизводные

| 
| 
| 
|
| хлорбензол | о-хлортолуол | м-хлортолуол | п-хлортолуол |
б) Полигалогенопроизводные

| 
| 
| 
|
| о-дихлорбензол | м-дихлорбензол | п-дихлорбензол | гексахлорбензол |
2.Вид соединения галогена с углеродом боковой цепи.
а) моногалогенпроизводные
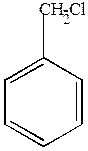
хлористый бензил
б) полигалогенпроизводные

| 
|
| хлористый бензилиден | бензотрихлорид |
Получение
1.Действие галогенов на ароматические углеводороды (см.свойства ароматических углеводородов, реакции электрофильного замещения);
2. Из первичных ароматических аминов через соли диазония.
CuCl
C6H5NH2 + O=N-OH + HHal  C6H5N2Hal
C6H5N2Hal  C6H5Hal + N2
C6H5Hal + N2
-2H2O
(подробнее см.получение и свойства ароматических диазосоединений).
3. Получение соединений с галогеном в боковой цепи.
а) реакция хлорметилирования

| + | 
| ZnCl2
+ HCl  -H2O
-H2O
| 
|
| формальдегид | хлористый водород | хлористый бензил |
б) замещение группы ОН в ароматических спиртах на галоген
C6H5CH2OH + HCl  C6H5CH2Cl
C6H5CH2Cl
-H2O
хлористый бензил
Физические свойства галогенопроизводных ароматических углеводородов
Жидкости или твердые вещества, практически нерастворимы в воде. Плотность больше 1. Соединения с Hal в боковой цепи обладают раздражающим запахом и слезоточивым действием.
Химические свойства
Галогенопроизводные ароматических углеводородов обладают в основном теми же свойствами, что и галогенопроизводные жирного ряда, но отличаются различной активностью в реакциях нуклеофильного замещения атома галогена.
а) соединения 1 типа (галоген связан с углеродом ядра) вступают в реакции нуклеофильного замещения галогена с большим трудом. Так, реакция гидролиза хлорбензола протекает под действием водного раствора щелочи лишь при 300-3500С, под давлением и в присутствии катализатора – мелко раздробленной меди.

| 300-3500C
P, Cu
+ NaOH  NaCl + NaCl +
| 
|
Причиной является наличие эффекта р-  -сопряжения неподеленной пары электронов хлора и
-сопряжения неподеленной пары электронов хлора и  -электронов кольца. Благодаря этому уменьшается полярность связи С-Cl, уменьшается положительный заряд у углерода, что затрудняет атаку нуклеофильного реагента.
-электронов кольца. Благодаря этому уменьшается полярность связи С-Cl, уменьшается положительный заряд у углерода, что затрудняет атаку нуклеофильного реагента.

Подвижность хлора может быть увеличена, если в о- или п-положение к Hal ввести нитрогруппу, т.к. электроноакцепторная нитрогруппа способствует увеличению +  у углерода, связанного с галогеном.
у углерода, связанного с галогеном.

Замещение Hal в ядре идет по механизму SN2 через промежуточную стадию образования дегидробензола.

|
+ NaOH  -NaCl
-H2O
-NaCl
-H2O
| 
|
 HOH HOH
|  
| 
|
| п-хлортолуол | дегидротолуол | м-крезол, 50% | |||

| 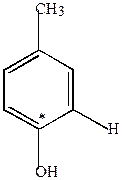
| ||||
| п-крезол |
б) Галогенопроизводные с галогеном в боковой цепи (у  -углеродного атома), наоборот, более активны, чем соединения жирного ряда (ведут себя как соединения аллильного типа).
-углеродного атома), наоборот, более активны, чем соединения жирного ряда (ведут себя как соединения аллильного типа).
Причина – в промежуточном образовании очень устойчивого сопряженного карбиона, благодаря чему реакции идут всегда по механизму SN1, например,

| медленно
 Cl- +
диссоциация
на ионы Cl- +
диссоциация
на ионы
| 
| быстро
HOH

| 
| +H+ |
| Хлористый бензил А |
r=k[A]
Кроме реакций нуклеофильного замещения, ароматические галогенопроизводные дают реакцию образования металлорганичсеких соединений.
Значение: галогенопроизводные ароматического ряда используются в качестве растворителей и ядохимикатов.
Ароматические сульфокислоты
| общая формула | 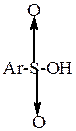
| |||

| 
| 
| ||
| Бензолсульфокислота | П-толуолсульфокислота | М-бензолдисульфокислота | ||
Получают, в основном, путем сульфирования ароматических углеводородов.
1) При использовании серной кислоты в качестве сульфирующего агента необходимо брать избыток кислоты, т.к. при разбавлении серной кислоты до 65% реакция сульфирования прекращается, наступает равновесие.
Для смещения равновесия можно брать также избыток бензола, и образующуюся воду отгоняют в виде азеотропов с бензолом.
2) Особенно хорошо идет реакция сульфирования при действии олеума.

|

| 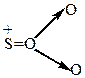
|

| 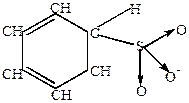
|

| 
| |
| оксид серы | биполярный ион |  -комплекс -комплекс
| |||||

| 
|
Реакция идет при действии эквимолекулярного количества SO3 при комнатной температуре.
C6H5-SO2-OH + H-C6H5  -HOH
-HOH
| 
|
Физические свойства
Обусловлены наличием очень полярной сульфогруппы. Сульфокислоты имеют высокие температуры кипения и перегоняются только в глубоком вакууме. Это кристаллические вещества, бесцветные, очень гигроскопичные, прекрасно растворяются в воде, плохо – в органических растворителях.
Химические свойства
Сульфокислоты ароматического ряда - вещества достаточно высокой реакционной способности. Среди ароматических соединений сульфокислоты имеют такое же значение, как галогенопроизводные среди соединений жирного ряда.
|
Просмотров 1773 |
|
|
