
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Нитросоединения ароматического ряда
|
|
Подразделяются на лекции 7.
1.Нитросоединения с нитрогруппой в ядре.
2.Нитросоединения с нитрогруппой в боковой цепи.
Нитросоединения с нитрогруппой в ядре
Способы получения
1.Нитрование ароматических углеводородов в условиях реакции электрофильного замещения (нитрующая смесь).
2.Замещение Cl в галоидарилах, когда Cl активирован нитрогруппой, расположенной в о- или п-положении, например, по механизму электрофильного замещения.

|
+ KNO2  KCl + KCl +
| 
|
| п-хлорнитробензол | азотистокислый калий | п-динитробензол |
3. Через соли диазония

|
+ KNO2  KCl + N2 + KCl + N2 +
| 
|
| п-сульфофенилдиазоний | азотистокислый калий | п-нитробензолсульфокислота |
Физические свойства
Жидкие или твердые вещества с характерным миндальным запахом. Окрашены в желтый цвет, ядовиты, в воде не растворимы, d>1.
Полинитросоединения

| 
|
Взрывчаты (тротил, тол)
Химические свойства
1.Реакции восстановления нитрогруппы.
Впервые были осуществлены в Казани в 1841 году Н.Н.Зининым (учитель А.М.Бутлерова). Нитросоединения приобрели важнейшее практическое значение ввиду того, что нитросоединения ароматического ряда – вещества легко доступные, а ароматические амины и другие вещества, получаемые при восстановлении нитросоединений, необходимы для производства красителей, лекарств, фотохимикатов, антиоксидантов, полимерных материалов.
Реакция восстановления нитросоединений ароматического ряда может привести к образованию различных продуктов. Решающую роль в направлении реакции играет среда.
1) Восстановление в нейтральной, слабокислой или слабощелочной среде (действие Fe+H2O, электрохимическое восстановление в нейтральной среде).

| 2H 2H
+ 2H  H2O + C6H5-N=O H2O + C6H5-N=O  C6H5-NH-OH C6H5-NH-OH  C6H5NH2 + H2O
нитрозобензол фенилгидроксиламин анилин C6H5NH2 + H2O
нитрозобензол фенилгидроксиламин анилин
|

|
Эту реакцию можно остановить на любой стадии. Фенилгидроксиламин может давать перегруппировку в п-аминофенол, если его поместить в кислую среду.
2) при проведении реакции восстановления в сильнокислой среде промежуточные соединения те же, но реакция идет так быстро, что остановить ее на промежуточных стадиях не удается. Конечный продукт – анилин. Восстановители – Zn, Fe+кислота, H2S.
3) Восстановление в щелочной среде.
Идет более сложно.
+2H
С6H5NO2 + 2H  C6H5N=O
C6H5N=O  C6H5NHOH
C6H5NHOH
-H2O
нитробензол фенилгидроксиламин
| С6H5-N=O + | 
|
 H2O + H2O +
| 
| 2H

|
| Азоксибензол | ||||
2H 2H
 H2O + C6H5-N=N-C6H5 H2O + C6H5-N=N-C6H5  C6H5-NH-NH-C6H5 C6H5-NH-NH-C6H5  2C6H5NH2
азобензол гидразобензол 2C6H5NH2
азобензол гидразобензол
|
Восстановление нитросоединений можно проводить и молекулярным водородом в присутствии катализаторов Cu, Pd, Ni.
II. Реакции в ядре
1) Реакции электрофильного замещения в ароматическом ядре.
Происходят в м-положении к нитрогруппе (т.к. это заместитель II рода) и протекает значительно труднее, чем у углеводородов.
а) галоидирование

|
(Fe)
+ Br2  HBr +
t0 HBr +
t0
| 
|
| м-бромнитробензол |
б) нитрование – требует более высокой температуры.
в) сульфирование – только олеумом или хлорсульфоновой кислотой (т.е. хлорангидрид серной кислоты).
2) Реакции нуклеофильного замещения в ароматическом ядре.
Являясь сильным электроноакцептором, нитрогруппа понижает электронную плотность кольца и особенно сильно в о- и п-положении, поэтому в этих положениях могут довольно легко идти реакции нуклеофильного замещения, которые почти не имеют места у ароматических углеводородов.
а) нуклеофильное замещение водорода в о- или п-положении к нитрогруппе.
1. Взаимодействие со щелочами

|
t0
+ KOH  H2 +
(тв.) H2 +
(тв.)
| 
|
| О-нитрофенолят калия |
Нуклеофильное замещение идет легче, если в молекуле имеются две нитрогруппы в м-положении.

|
+ KOH  H2 +
(раствор) H2 +
(раствор)
| 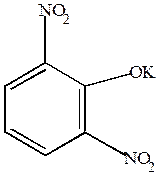
|
| м-динитробензол | 2,6-динитрофенолят калия ярко-фиолетовое окрашивание |
б) нуклеофильное замещение других атомов или групп, находящихся в о- или п-положениях к нитрогруппе (особенно легко замещаются галогены в о- или п-положении к нитрогруппе).

|
+ KOH  KCl +
(водный) KCl +
(водный)
| 
|
| о-хлорнитробензол | о-нитрофенол |
Реакция с замещением галоида в этом случае идет легко.
|
Просмотров 1544 |
|
|
