
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

II. Реакции замещения водорода в аминогруппе. Эти реакции типичны для первичных и вторичных аминов и протекают в основном так же, как для аминов жирного ряда
|
|
Эти реакции типичны для первичных и вторичных аминов и протекают в основном так же, как для аминов жирного ряда, за некоторыми исключениями.
1) Алкилирование и арилирование. Реакция используется для получения вторичных и третичных ароматических аминов.
а) алкилирование
NaOH
С6H5NH2+CH3O-SO2-OCH3  C6H5-NH-CH3 + HOSO2OCH3
C6H5-NH-CH3 + HOSO2OCH3  CH3OSO2Na
CH3OSO2Na
-H2O
диметилсульфат метиланилин метилсерная кислота натриевая соль
метилсерной кислоты
б) арилирование применяется для получения чисто ароматических вторичных и третичных аминов из первичных.
Получаются нагреванием солей первичных аминов.
нагревание
С6H5NH3Cl + C6H5NH2 . HCl  NH4Cl + C6H5NH-C6H5 . HCl
NH4Cl + C6H5NH-C6H5 . HCl
дифениламин солянокислый
Третичные амины получают действием йодистого арила в присутствии катализатора Cu на вторичные ароматические амины.

| Cu
+ IC6H5  -HI
-HI
| 
|
| дифениламин | йодбензол | трифениламин |
2) Ацилирование ароматических аминов – замещение Н остатком кислоты – ацилом

Осуществляется действием ангидридов, хлорангидридов кислот или свободных карбоновых кислот.
Например,
| . . C6H5NH2 + | 
|

| 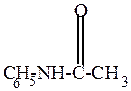
| + | 
|
| уксусный ангидрид | ацетанилид (или N-фенилацетамид) (антифебрин – жаропонижающее средство februs - лихорадка) |
(Реакция часто используется для защиты аминогруппы от окисления).
3. Взаимодействие ароматических аминов с азотистой кислотой
а) первичные ароматические амины при действии солей азотистой кислоты в кислой среде образуют соли диазония
б) вторичные ароматические амины реагируют с образованием нитрозоаминов.
С6H5-NH-CH3+HO-N=O  H2O + H2O +
| 
| [H+]
 n-O=N-C6H4-NH-CH3 n-O=N-C6H4-NH-CH3
|
| N-нитрозоме-тиланилин | п-нитрозо-N-метиланилин |
В кислой среде могут давать перегруппировки
в) третичные ароматические амины, в отличие от третичных жирных аминов, реагируют с HNO2, но за счет ароматического ядра.

|
+ HON=O  H2O + H2O +
| 
| |||||||
| N,N-диметиланилин | п-нитрозодиметиланилин | ||||||||

| . .
+[O :]  . .
. .
| 
| O
 -H2O
-H2O
| 
| H2O
 NH3 + NH3 +
| 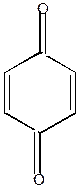
| |||
| K2Cr2O3 . H2SO4 | аминооснование | хинонимин | п-бензохинон | ||||||
С помощью этих реакций различают первичный, вторичный и третичный амины.
IV. Окисление
Ароматические амины легко окисляются. Даже при хранении под действием воздуха анилин сначала буреет, затем чернеет.
В зависимости от применяемых окислителей реакция может привести к образованию различных продуктов.
а) при окислении хромовой смесью образуется хинон.
При окислении хлорной известью появляется фиолетовая окраска, при окислении К2Cr2O7 и разбавленной H2SO4 – зеленая окраска.
б) некоторые виды окислителей способны окислять аминогруппу до нитрогруппы.
| C6H5NH2 + 3 | 
|
 3 CF3COOH + H2O + C6H5NO2 3 CF3COOH + H2O + C6H5NO2
|
| гидроперекись трифторацетила | трифторуксусная кислота нитробензол |
V. Реакции замещения в ароматическом ядре
Ароматические амины галоидируются, нитруются и сульфируются в положении о- и п-. Эти реакции облегчаются под влиянием группы NH2, заместителя I рода, активирующего ядро.
1) Галоидирование
Бромирование протекает под действием водного раствора брома при комнатной температуре

|
+ 3 Br2  (H2O) -HBr
(H2O) -HBr
|  
|
| 2,4,6-триброманилин |
из воды белый осадок
Реакция применяется как качественная.
|
Просмотров 1370 |
|
|
