
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

IV. Конденсация фенолов с другими органическими соединениями
|
|
С-алкилирование или С-ацилирование ароматического ядра в орто- или пара-положении к окси-группе, разновидность реакций электрофильного замещения.
1) С-алкилирование фенолов олефинами
 
| 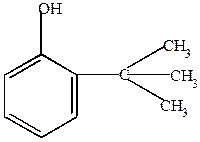
| |||||||
| о- или п-третбутилфенол | ||||||||

| + | 
|
AlCl3 (HCl)
БСК и др. | |||||

| 
|
2) Конденсация фенолов с альдегидами и кетонами
а) образование фенолоспиртов и бисфенолов

| ||||||||
|  + +  -
+ СН2=О -
+ СН2=О
| Н+

| 
|
 H2O + H2O +
| ||||
| муравь-иный альдегид | n-метилолфенол | |||||||

| ||||||||
| 4,4/-метиленбисфенол | ||||||||
| HO-C6H4-H + | 
|
+ H-C6H4-OH  H2O + H2O +
| 
| |||||
| Фенол | ацетон | 4,4/-изопропилиденбисфенол | ||||||
Бисфенолы применяются для синтеза эпоксидных смол полиарилатов и поликарбонатов.
3) Поликонденсация фенолов с формальдегидом с образованием фенолформальдегидных смол.
а) линейного строения (при недостатке альдегида поликонденсация протекает за счет атома водорода в о-положении)
| …+ | 
| + |

| + | 
| + |

|
+…  -H2O
-H2O
|

| 
|
б) сшитого трехмерного строения (при избытке альдегида за счет атомов водорода как о-, так и п-положения образуются трехмерные сетчатые полимеры (бакелит)).

|
 -H2O
-H2O
|

| |

|
4) Реакция Кольбе – конденсация фенолятов с СО2
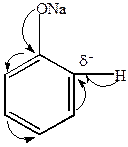
| + | 
|
180-2000С
 Р
Р
| 
|

| 
|
| Натриевая соль салициловой кислоты |
Салициловокислый натрий – вещество, которое используется для получения различных лекарств.

|
+ HCl  -NaCl
-NaCl
| 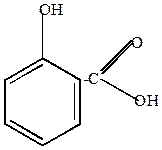
|
| салициловая кислота |
Может образовывать 2 типа сложных эфиров за счет группы ОН и за счет группы СООН.
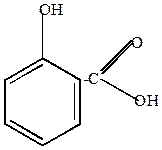
| + | 
|

| 
| + CH3COOH |
| ацетилсалициловая кислота (аспирин) |
Ароматические спирты
По способам получения и свойствам почти не отличаются от алифатических. Резко отличаются от фенолов тем, что не проявляют кислотных свойств. Вещества с приятным запахом.
Бензиловый спирт С6Н5СН2ОН
Получение
1) Гидролиз хлористого бензила
C6H5CH2Cl + HOH  HCl + C6H5CH2OH
HCl + C6H5CH2OH
Свойства
Жидкость с очень приятным запахом. Входит в состав перуанского и толуанского бальзамов, эфирных масел, жасмина, гиацинта.
Применение
1. Получение синтетических душистых веществ (сложные эфиры его с уксусной кислотой, бензойной и коричной кислотами);
2. Сам бензиловый спирт и его эфиры используются в медицине как анестезирующие средства.
 -фенилэтиловый спирт С6Н5-СН2-СН2-ОН
-фенилэтиловый спирт С6Н5-СН2-СН2-ОН
Жидкость с очень приятным запахом, входит в состав розового и гвоздичного масел.
Получение:
 -
-  +
+  +
+  - HOH
- HOH
C6H5  MgCl + CH2-CH2-O
MgCl + CH2-CH2-O  C6H5-CH2-CH2-OMgCl
C6H5-CH2-CH2-OMgCl 
фенилмагний хлорид окись этилена  -фенилэтоксимагнийхлорид
-фенилэтоксимагнийхлорид
 MgCl(OH) + C6H5-CH2-CH2-OH
MgCl(OH) + C6H5-CH2-CH2-OH
Применяется для получения душистых веществ.
Хиноны
К ним относятся циклические ненасыщенные дикетоны, получаемые окислением ароматических соединений, содержащих окси-группы и имеющие характерную “хиноидную” структуру, где две двойные связи кольца находятся в замкнутом сопряжении с двойными связями кето-групп.

| 
|
| Орто-бензохинон | пара-бензохинон |
Способы получения
1) Окисление одноатомных фенолов или аминов (см.свойства фенолов и аминов);
2) окисление орто- и пара-бифункциональных ароматических соединений, содержащих хотя бы одну окси- или аминогруппу (двухатомных фенолов, диаминов, аминофенолов, аминосульфокислот).

|
+ H2O
+ 2О 
| 
| + NH4(HSO4) |
| сульфаниловая кислота | п-бензохинон | кислый сернокислый аммоний |
3) прямое окисление ароматических углеводородов (электрохимическое окисление бензола на свинцовом аноде).

|
+ 3О 
| 
| + H2O |
| п-бензохинон |
Физические свойства
Это твердые кристаллические вещества, имеющие окраску (хиноидная группа относится к хромофорам). Легко возгоняются, растворяются в органических растворителях.
Химические свойства
Проявляют свойства ненасыщенных кетонов. Активно вступают в реакции присоединения по двойным связям, дают некоторые реакции карбонильных соединений.
Основное отличие их от обычных ненасыщенных кетонов в том, что многие реакции хинонов сопровождаются перестройкой “хиноидного” кольца в “бензоидное”.
I. Реакции присоединения по двойным связям.
1. Реакции присоединения по двойным связям С=С.
Например, галогенов

|
+ 2HCl 
| 
|
| п-бензохинон | 2,3,5,6-тетрахлор-1,4-циклогександион |
2. Присоединение водорода по концам системы 3-х сопряженных двойных связей (двух связей С=О и одной С=С). Например,

|
+2Н 
| 
|
| п-гидрохинон |
хиноидное кольцо при этом восстанавливается до бензоидного.
II. Реакции карбонильных групп.
Например,

|
+ NH2OH  H2O + H2O +
| 
| NH2OH
 H2O + H2O +
| 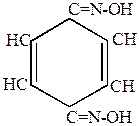
|
| п-бензохинон | гидроксиламин | хинонмонооксим |  
| хинондиоксим |

| ||||
| п-нитрозофенол |
Наибольшее практическое значение имеет п-бензохинон (хинон), открытый в 1838 году Воскресенским. Желтое кристаллическое вещество с резким запахом, Тпл=1160С. Легко возгоняется. С гидрохиноном образует ярко окрашенное комплексное соединение – хингидрон – темно-зеленое кристаллическое вещество, представляющее интерес в качестве окислительно-восстановительной системы.

III. Окислительно-восстановительные свойства хингидрона
При растворении хингидрона в щелочи образуется семихинон – устойчивый ион-радикал, где отрицательный заряд распределяется между обоими атомами кислорода.

|
+2NaOH
 2Na+ +
-2H2O 2Na+ +
-2H2O
| 
| + | 
|

| 
|
| хингидрон | анион п-гидрохинона | семихинон |
Семихинон может легко отдавать и принимать электроны, превращаясь при этом либо в хинон, либо в гидрохинон.

|
- 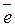

| 
|
+ 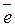

| 
|
| п-бензохинон | ион гидрохинона |
Поэтому хингидрон используется в качестве окислительно-восстановительной системы, служащей посредником при передаче электронов, например, для изготовления хингидронного электрода.
|
Просмотров 1488 |
|
|

