
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Отдельные представители альдегидов
|
|
Бензальдегид – бесцветная маслообразная жидкость с запахом горького миндаля. В природе встречается в виде глюкозида амигдалина. Промышленный способ получения – окисление толуола или гидролиз хлористого бензилидена. Применяется в парфюмерной промышленности, в синтезах получения коричной кислоты, получение красителей ряда трифенилметана (малахитовая зелень, фуксин и др.), очень легко окисляется.
Салициловый альдегид – получается с помощью реакции Тимана-Реймера из фенола.

Технический способ получения.

|
C6H5SO2Cl
 HCl +
(защита
группы ОН
от окисления) HCl +
(защита
группы ОН
от окисления)
| 
|
2MnO2
2H2SO4

| 
|
HOH

|
| о-крезиловый эфир бензилсульфокислоты | |||||
 C6H5SO2OH +
бензилсульфокислота C6H5SO2OH +
бензилсульфокислота
| 
|
Ванилин

(4-окси-3-метоксибензальдегид) – белое кристаллическое вещество с приятным ароматическим запахом. Легко растворяется в спирте применяется как вкусовое вещество.
Отдельные представители кетонов
Ацетофенон - -нерастворим в воде. Маслянистая жидкость с запахом черемухи. Получают окислением этилбензола, ацетилированием бензола. Применяется в парфюмерии, в медицине как снотворное, в синтезах (хлорацетофенона – ОВ,  -фенилэтилового спирта – приятно пахнущее вещество, в реакциях конденсации – получение непредельных кетонов).
-фенилэтилового спирта – приятно пахнущее вещество, в реакциях конденсации – получение непредельных кетонов).
Бензофенон – кристаллическое вещество, существует в 2-х модификациях, с Тпл=260С – неустойчивое и с Тпл=480С – устойчивое.
Техническое получение – реакция Фриделя-Крафтса.

| AlCl3

| 
|

| 
| + HCl |
1) Бензол + хлористый бензоил;
2) Бензол + CCl4 и затем гидролиз:
3) Пиролиз (С6Н5СОО)2Са
Применяется в парфюмерии, в получении трансформаторных масел
Его производное – кетон Михлера – используется в синтезе красителей.

| AlCl3
 2
-2HCl 2
-2HCl
| 
| + | 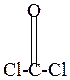
|
| фосген |
Ароматические кислоты
Классификация
| Чисто ароматические (группа СООН связана с ядром) | жирно-ароматические (группа СООН связана с углеродом боковой цепи) | ||
| одноосновные | многоосновные | ||
 бензойная
бензойная
|  фталевая
фталевая
|  Фенилуксусная
Фенилуксусная
|  Терефталевая
Терефталевая
|
 о-толуиловая, изомеры –
м-толуиловая, п-толуиловая
о-толуиловая, изомеры –
м-толуиловая, п-толуиловая
|  изофталевая
изофталевая
| 
 -фенилмасляная -фенилмасляная
|  1,3,5-бензолтрикарбоновая
1,3,5-бензолтрикарбоновая
|
 Коричная (
Коричная (  -фенилакриловая) -фенилакриловая)
|
Способы получения
Общие способы.
1. Через нитрилы:
HOH
C6H5CH2Br + KCN  KBr + C6H5-CH2=C
KBr + C6H5-CH2=C  N
N  NH3 + C6H5-CH2-COOH
NH3 + C6H5-CH2-COOH
бензилбромид нитрил фенилуксусной кислоты фенилуксусная кислота
2. Через Мg-органические соединения:
CO2
С6H5Cl+Mg  C6H5MgCl C6H5MgCl 
| 
| HOH

| 
| +Mg(OH)Cl |
| фенилхлорид | фенилмагнийхлорид | бензойная кислота |
3. Гидролизом тригалоидпроизводных:

|
+ 2H2O  3 HCl + 3 HCl +
| 
|
| бензотрихлорид |
4. Окислением ароматических спиртов, альдегидов, кетонов.
2О

 C6H5CH2OH C6H5COOH
C6H5CH2OH C6H5COOH
бензиловый спирт
О


бензальдегид
Специфические способы:
1) Окисление ароматических углеводородов с боковыми цепями – имеет препаративное значение и применяется в промышленности. Окислители: хромовая кислота, KMnO4 (смотри свойства предельных углеводородов).
2) Окисление метилкетонов гипогалогенитами (см.свойства ароматических альдегидов и кетонов).
4) Реакция Фриделя-Крафтса с фосгеном при использовании рассчитанного количества ароматического углеводорода:

| + | 
| AlCl3
 HCl +
безв. HCl +
безв.
| 
| HOH
 HCl + HCl +
| 
|
| бензоилхлорид (хлорангидрид бензойной кислоты) |
5) через сульфокислоты (сплавлением с цианидами)

| сплавление
+NaCN  Na2SO3+ Na2SO3+
| 
| 2H2O
 NH3 + NH3 +
| 
|
| Na-соль бензол-сульфо-кислоты | бензонитрил |
6) через диазосоединения:

|
+KCN  KCl+N2+ KCl+N2+
| 
| H+OH-

| |
| хлористая соль фенилдиазония | бензонитрил | |||

|

| 
| HOH
 NH3+ NH3+
| 
|
Физические свойства
Кристаллические бесцветные вещества, плохо растворимые в холодной воде (лучше при нагревании), обладают высокими температурами плавления (бензойная кислота – 1220С, п-толуиловая – 1810С), возгоняются.
Химические свойства
Проявляют общие свойства карбоновых кислот, т.е.
1) кислотная диссоциация

|
 C6H5COO- + H+ C6H5COO- + H+
|
2) образование солей

|
+ NaOH 
| 
| +HOH |
3) образование сложных эфиров

|
+C2H5OH 
| 
| +HOH |
хлорангидридов, амидов

|
+NH2C2H5 
| 
|
Особенности свойств:
1. Кислоты, у которых группа –СООН связана непосредственно с ядром, обладают более сильными кислотными свойствами по сравнению с кислотами жирного ряда (за исключением муравьиной кислоты).
| Формула | Константа диссоциации |
 Муравьиная кислота
Муравьиная кислота
| 2,1.10-14 |
 Бензойная кислота
Бензойная кислота
| 6,5.10-5 |
 Уксусная кислота
Уксусная кислота
| 1,8.10-5 |
Это объясняется следующим: кислотные свойства обуславливаются тем, насколько сильно оттянута электронная пара от водорода, что зависит не только от явления взаимного влияния атомов в самой карбоксильной группе (показаны у муравьиной кислоты), но и от влияния радикала. Все углеводородные радикалы обладают электронодонорными свойствами и уменьшают полярность связи О-Н по сравнению с муравьиной кислотой, но у Ar донорные свойства выражены слабее, чем у Alk.
Различная сила кислотных свойств проявляется в реакциях вытеснения кислот из их солей.
CH3COONa + C6H5COOH 
 C6H5COONa + CH3COOH
C6H5COONa + CH3COOH
ацетат натрия бензойная кислота растворимо в воде уксусная кислота
(нерастворима в воде)
При введении в ароматическое ядро электронодонорных групп константа диссоциации уменьшается, при введении электроноакцепторной группы – увеличивается.
| Формула кислоты | Константа диссоциации |
| C6H5COOH | 6,5.10-5 |
| o-CH3C6H4COOH | 6,95.10-3 |
| o-NO2C6H4COOH | 1,2.10-3 |
2) Образование хлорангидридов может происходить не только при действии PCl5

|
+ PCl5 
| 
| + | 
| + HCl |
но и другими путями:
а) при непосредственном действии хлора на ароматические альдегиды. Хлор при этом замещается Н в альдегидной группе, т.к. нет подвижного водорода в  -положении.
-положении.

|
+ Cl2  HCl + HCl +
| 
|
б) при гидролизе бензотрихлорида ограниченным количеством воды:

|
+ H2O  2 HCl +
-HCl 2 HCl +
-HCl
| 
|
| бензотрихлорид |
3) Благодаря плоскому жесткому строению бензольного кольца реакционноспособность карбоксильной группы зависит от пространственных факторов.
Например, реакция этерификации ароматических кислот при наличии двух заместителей в о-положении не идет вследствие пространственных затруднений.

| + ROH |
| 1-метил-6-третбутилбензойная кислота |
4) Реакции в ароматическом ядре.
Реакции электрофильного замещения в ядре затруднены, т.к. группа СООН обедняет ядро электронами. Однако, электроноакцепторные свойства группы СООН выражены слабее, чем у других заместителей 2 рода (нитро-, нитрильной, альдегидо-, кетоно- и сульфогрупп). В карбоксильной группе имеет место сопряжение карбонильного остатка с гидроксильной группой, положительный заряд у карбоксильного углерода уменьшается, и он слабее притягивает к себе  -электроны ароматического ядра.
-электроны ароматического ядра.

Поэтому реакции замещения могут идти не только в мета-положении, но и в орто- и в пара-. Так, при нитровании бензойной кислоты образуется 20% о-нитробензойной кислоты, 78% - мета- и 2% - пара-.

|
+ HNO3  [H2SO4]
[H2SO4]
| 
| м- 78% |
| о- 20% | |||
| п- 2% |
Отдельные представители
Бензойная кислота С6H5COOH – входит в состав различных ароматических веществ, встречающихся в природе.
Перуанский бальзам (бензиловый эфир бензойной кислоты), клюква.
Промышленное получение
Окисление толуола избытком кислорода

| 1500C
(нафтенат, кобальт)
+ 1,5 O2  Р=4 ат
Р=4 ат
| 
| +H2O |
Применение
1) консервант используется в медицине в виде Na-соли;
2) эфиры – в парфюмерии.
|
Просмотров 1956 |
|
|
