
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Соединений по периодам, группам и подгруппам
|
|
1 Электронную конфигурацию 1s22s22p63s23p64s1 имеет атом:
1) Ва; 2) Са; 3) К; 4) Na.
2 Изотоп  содержит нейтронов:
содержит нейтронов:
1) 7; 2) 6; 3) 13; 4) 19.
3 Изотопы расположены в ряду:
1)  ,
, 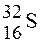 ,
,  ; 2)
; 2)  ,
,  ,
,  ;
;
3)  ,
,  ,
,  ; 4)
; 4)  ,
,  ,
,  .
.
4 Максимальное число электронов на s-подуровне равно:
1) 2; 2) 6; 3) 10; 4) 14.
5 Максимальное число электронов на р-подуровне равно:
1) 2; 2) 6; 3) 10; 4) 14.
6 Максимальное число электронов на d-подуровне равно:
1) 2; 2) 10; 3) 6; 4) 14.
7 Максимальное число электронов на f-подуровне равно:
1) 2; 2) 6; 3) 10; 4) 14.
8 Атом элемента, в котором заполняется d-подуровень:
1) Ni; 2) Be; 3) Pb; 4) Mg.
9 Число нейтронов в ядре атома элемента с внешним уровнем ...3d64s2 равно:
1) 26; 2) 56; 3) 30; 4) 16.
10 Максимальное число электронов на подуровне определяется формулой:
1) 2l+1; 2) n-1; 3) 2(2l+1); 4) 2n2.
11 Максимальное число электронов на энергетическом уровне определяется
формулой:
1) 2l+1; 2) n-1; 3) 2(2l+1); 4) 2n2.
12 Электронную конфигурацию ..3s23p63d84s2 имеет атом:
1) Zn; 2) Ni; 3) Mg; 4) Cl.
13 Число неспаренных электронов в нормальном состоянии больше у атома:
1) Na; 2) Si; 3) P; 4) Cl.
14 Число электронов у фосфора со степенью окисления -3 равно:
1) 15; 2) 31; 3) 18; 4) 16.
15 Число электронов серы в степени окисления +6 равно:
1) 16; 2) 32; 3) 10; 4) 12.
16 Атом хлора в максимально возбужденном состоянии имеет формулу:
1) 1s22s22p63s23p5; 2) 1s22s22p63s23p3d1;
3) 1s22s22p63s23p33d2; 4) 1s22s22p63s13p33d3.
17 Электронная конфигурация иона Mg2+ соответствует формуле:
1) 1s22s22p63s2; 2) 1s22s22p6;
3) 1s22s22p63s23p1; 4) 1s22s22p63s1.
18 Электронная конфигурация иона S2- соответствует формуле:
1) 1s22s22p63s23p4; 2) 1s22s22p63s23p33d1;
3) 1s22s22p63s2sp6 ; 4) 1s22s22p6.
19 Заполнение p-подуровня происходит у атома:
1) Na; 2) Ca; 3) Al; 4) Li.
20 s-элементы находятся в ряду:
1) Li, Na, Be; 2) Li, Be, C; 3) Na, C, O; 4) Fe, Mn, Ni.
21 Является d-элементом:
1) Na; 2) Fe; 3) Ca; 4) Rb.
22 Порядковый номер элемента - это:
1) сумма протонов и нейтронов;
2) разница атомной массы и числа протонов;
3) число протонов;
4) число нейтронов.
23 Электронную конфигурацию ...3s23p3 имеет:
1) хлор; 2) бериллий; 3) азот; 4) фосфор.
24 Электронная конфигурация атома хлора 1s22s22p63s23p43d1 соответствует
валентности:
1) 1; 2) 3; 3) 5; 4) 7.
25 Электронную конфигурацию 1s22s22p63s23p6 имеет хлор в степени окисления:
1) -1; 2) +1; 3) +7; 4) 0.
26 Типичным неметаллом является:
1) бор; 2) алюминий; 3) галлий; 4) индий.
27 Металлический характер свойств элементов в ряду Mg-Ca-Sr-Ba:
1) уменьшается; 2) возрастает;
3) не изменяется; 4) уменьшается, а затем возрастает.
28 Неметаллический характер свойств элементов в ряду N-P-As-Sb-Bi
1) уменьшается; 2) возрастает;
3) не изменяется; 4) уменьшается, а затем возрастает.
29 Характер оксидов в ряду P2O5 - SiO2 - Al2O3 - MgO меняется от:
1) основного к кислотному; 2) основного к амфотерному;
3) кислотного к основному; 4) амфотерного к кислотному.
30 Основные свойства гидроксидов в ряду LiOH-NaOH-KOH- RbOH:
1) усиливаются; 2) ослабевают;
3) не изменяются ; 4) усиливаются, затем ослабевают.
31 Кислотными свойствами обладает оксид марганца:
1) Mn2O3; 2) MnO; 3) MnO2; 4) Mn2O7;.
32 Только амфотерные оксиды находятся в ряду:
1) Аl2O3, Na2O, FeO; 2) BeO, Al2O3, PbO;
3) CuO, ZnO, K2O; 4) CaO, MgO, BaO.
33 Неметаллический характер свойств элементов в ряду О-S-Se-Te-Po:
1) уменьшается; 2) возрастает;
3) не изменяется; 4) уменьшается, затем возрастает.
34 Металлический характер свойств элементов в ряду Ве-Мg-Ca-Sr-Ba-Ra:
1) уменьшается; 2) возрастает;
3) не изменяется; 4) уменьшается, затем возрастает.
35 Наиболее сходными химическими свойствами обладает пара элементов:
1) Al, C; 2) Ni, P; 3) Li, Na; 4) Mg, Cl.
36 Только щелочные металлы находятся в ряду:
1) Ca, Mg, Al; 2) Li, Na,K; 3) Rb, Al, Ba; 4) K, Ca, Zn.
37 Cила кислот в ряду Н2SO4®HNO3®H2CO3®H2SiO3:
1) возрастает; 2) не изменяется;
3) уменьшается; 4) возрастает, затем уменьшается.
38 Сила кислот в ряду НСlO®HClO2®HClO3®HClO4:
1) возрастает; 2) не изменяется;
3) уменьшается; 4) возрастает, затем уменьшается.
39 Электронную конфигурацию благородного газа имеет:
1) S; 2) O; 3) Mg; 4) Mg2+.
40 Устойчивость гидридов в ряду СH4-SiH4-GeH4 -SnH4:
1) уменьшается; 2) возрастает;
3) возрастает, затем уменьшается; 4) не изменяется.
41 Сродство к электрону возрастает в ряду:
1) Li - Na - K - Rb; 2) S - Se - Te - Po;
3) Si - P - S - Cl; 4) O - N - C - B.
42 Энергия ионизации в ряду Bi - Sb - As - P:
1) уменьшается; 2) увеличивается;
3) не изменяется; 4) уменьшается, затем увеличивается.
43 Металлические свойства сильнее выражены у атома с электронной
конфигурацией:
1) 3s23p2; 2) 4s2; 3) 3s23p6; 4) 3d104s1.
44 Указать ряд, в котором расположены только d-элементы:
1) Al, Sc, La; 2) Ti, Ge, Sn; 3) Ti, V, Cr; 4) La, Ce, Hg.
44 Сокращенная электронная конфигурация ...3s23p4 cоответствует формуле
высшего гидроксида элемента:
1) Э(ОН)2; 2) НЭО4; 3) Н2ЭО4; 4) Э(ОН)3.
45 Электронная формула атома Si в состоянии, предшествующем образованию
SiF4:
1) 1s22s22p63s23p2; 2) 1s22s22p63s23p6 ;
3) 1s22s22p63s13p3 ; 4) 1s22s22p6.
46 Электронная формула атома серы, предшествующая образованию
соединения SF6:
1) 1s22s22p63s23p6; 2) 1s22s22p63s23p4;
3) 1s22s22p63s13p33d2; 4) 1s22s22p63s23p33d1.
48 Возбужденное состояние невозможно для атома:
1) F; 2) Cl; 3) P; 4) N.
|
Просмотров 1259 |
|
|
