
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Тестовые задания для самоаттестации
|
|
Вариант № 0
1 Масса 2 моль газа СО2 при нормальных условиях составит (г/моль) :
1) 22,4; 2) 44; 3) 88; 4) 0,88.
2 Эквивалентная масса H2SO4 равна (г/моль):
1) 49; 2) 98; 3) 4,9; 4) 9,9.
3 р – элементом является:
1) Na; 2) P; 3) Mn; 4) Ca.
4 Электронная формула иона S2– :
1) 1s22s22p63s23p4;
2) 1s22s22p6;
3) 1s22s22p63s2;
4) 1s22s22p63s23p6.
5 Число электронных пар в молекуле О2:
1) 2; 2) 1; 3) 3; 4) 4.
6 Число нейтронов в атоме алюминия:
1) 27; 2) 14; 3) 13; 4) 40.
7 Ковалентная полярная связь образуется в соединении:
1) KCl; 2) N2; 3) H2O; 4) NH4Cl.
8 Сродство к электрону возрастает в ряду:
1) Si → P → S → Cl;
2) Li → Na → K → Rb;
3) O → N → C → B;
4)  S → Se → Te → Po.
S → Se → Te → Po.
9 Уменьшение концентрации NH 3 сместит равновесие в системе
N2 + 3H2 2NH3 :
1) вправо; 2) влево; 3) не сместит.
 10 Выражение константы равновесия для реакции N2 + 2O2 2NO2 имеет вид:
10 Выражение константы равновесия для реакции N2 + 2O2 2NO2 имеет вид:
1)  ; 2)
; 2)  ;
;
3)  ; 4)
; 4) 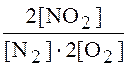 .
.
11 Для эндотермической реакции изменение энтальпии имеет значение:
1) ∆ Н > 0; 2) ∆ Н < 0; 3) ∆ Н = 0.
12 Слабым основанием является:
1) Ba(OH)2; 2) LiOH; 3) KOH; 4) Fe(OH)3.
13 Ионным уравнением  выражается реакция:
выражается реакция:
1) СаО + СО2 →; 2) CaCl2 + Na2CO3 →;
3) CaO + H2CO3 →; 4) CaCl2 + H2CO3 →.
14 Продуктами диссоциации H3PO4 по 1 ступени являются:
1) 2Н+,  ; 2) 3Н+,
; 2) 3Н+,  ; 3) 3Н+,
; 3) 3Н+,  4) Н2О, Р2О5.
4) Н2О, Р2О5.
15 Гидролизу не подвергается соль:
1) KNO3; 2) CuCl2; 3) K2S; 4) Li2CO3.
16 Реакция не протекает между ионами:
1) Ag+ + Cl–; 2) Ca2+ +  ; 3) Ba2+ +
; 3) Ba2+ + 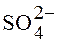 ; 4) 3K+ +
; 4) 3K+ +  .
.
17 Продуктами гидролиза соли Cu(NO3)2 по первой ступени являются:
1) CuOHNO3, H2O; 2) CuOHNO3, HNO3;
3) Cu(OH)2, HNO3; 4) Cu(OH)2, H2O.
18 Степень окисления изменяется в реакции:
1) H2S + Cl2 + H2O → H2SO4 + HCl;
2) CuCl2 + 2NaOH → Cu(OH)2 + 2 NaCl;
3) CaO + CO2 → CaCO3;
4) SO3 + H2O → H2SO4.
19 В полуреакции  + H+ → Mn2+ + H2O участвует молекул воды:
+ H+ → Mn2+ + H2O участвует молекул воды:
1) 8; 2) 6; 3) 4; 4) 5.
20 Продуктами электролиза расплава BaCl2 являются:
1) Ba, Cl2; 2) Ba(OH)2, Cl; 3) Ba, HCl; 4) Ba(OH)2, HCl.
21 К алкенам относится:
1) C2H6; 2) C2H4; 3) C2H2; 4) C6H6.
 22 Кето – группой является:
22 Кето – группой является:
 1) ; 2) ; 3) ; 4) .
1) ; 2) ; 3) ; 4) .
23 При хлорировании уксусной кислоты образуется:
 1) ; 2) ;
1) ; 2) ;




 3) ; 4) .
3) ; 4) .
24 Только основными свойствами обладает:
 1) СН3СООН; 2) CH3–NH2;
1) СН3СООН; 2) CH3–NH2;
 3) ; 4) .
3) ; 4) .
25 Простым эфиром является:
1) СН3–О–СН3; 2) С2Н5ОН;
 |
 3) ; 4) .
3) ; 4) .
26 3,4–диметил–1–гексин имеет формулу:
 |
 1) ; 2) ;
1) ; 2) ;
 |
 3) ; 4)
3) ; 4)
 27 Соединение имеет название:
27 Соединение имеет название:
1) 3–метил–2–пентанол; 2) 3–метил–2,4–пентадиол;
3) 2,4–пентандиол; 4) 2,2–диметил–3–пентанол.
 |
28 Альдегид образуется окислением спирта:
1) 1–бутанол; 2) 2–бутанол;
3) этанол; 4) метанол.
29 Кислотные свойства фенола подтверждаются реакцией:
1) С6Н5–ОН + Na →; 2) C6H5ONa + CO2 + H2O →;
3) C6H5ONa + Br2 →; 4) C6H5–OH + HNO3 →.
30 Реактивом на уксусный альдегид является:
1) Br2; 2) [Ag(NH3)2]OH;
3) KMnO4 + H2O; 4) HCl.
31 Реактивом на этиленгликоль является:
1) гидроксид натрия; 2) метиловый спирт;
3) азотная кислота; 4) гидроксид меди (II).
32 Циклизацией и ароматизацией н–гексана образуется:
 1) ; 2) С6Н6;
1) ; 2) С6Н6;
 3) СН3–(СН2)3–СН3; 4) .
3) СН3–(СН2)3–СН3; 4) .
33 Третичным амином является:
1) СН3–NH–CH3; 2) CH3–CH2–NH2;

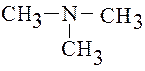 3) ; 4) .
3) ; 4) .
34 Мононитробензол образуется в реакции:
1) С6Н6  ; 2) С6Н5Сl
; 2) С6Н5Сl  ;
;
3) C6H5NO2  ; 4) CH3–C≡N
; 4) CH3–C≡N 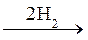
35 Конечным продуктом превращения CH3–C≡N 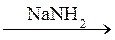 А
А  В
В  С
С  Д является:
Д является:
 1) 1–бутанол; 2) 2–бутанол;
1) 1–бутанол; 2) 2–бутанол;
3) масляный альдегид; 4) 2–метил–2–пропанол.

36 Полимер строения является:
1) полиэфиром; 2) полиамидом;
3) полиуретаном; 4) поликарбонатом.
37 Природным полимером является:
1) ацетат целлюлозы; 2) полистирол;
3) капрон; 4) белок.
38 Переход аморфного полимера из высокоэластического состояния в
вязкотекучее характеризуется температурой
1) стеклования; 2) хрупкости;
3) текучести; 4) разложения.
39 Время релаксации напряжения в полимерах с повышением температуры:
1) увеличивается;
2) уменьшается;
3) не изменяется.
40 Гибкость цепи макромолекул с увеличением ее длины
1) увеличивается;
2) уменьшается;
3) не изменяется.
42 Полимер сетчатого (пространственного) строения может образоваться при
поликонденсации мономера с числом функциональных групп
1) 1; 2) 2; 3) 3 и более; 4) не имеет значения.
42 Термопластичные полимеры при многократном нагревании
1) плавятся;
2) не плавятся;
3) остаются в стеклообразном состоянии.
43 Реакция полимеризации характерна для соединения
1) HO–CH2–CH2–OH; 2) CH2=CH–Cl;
3) CH3–CH2–Cl; 4) CH3–CH2–OH.
44 Эластичность полимера при введении пластификатора
1) повышается; 2) уменьшается;
3) не изменяется; 4) уменьшается незначительно.
45 Прочность полимера с повышением молекулярной массы
1) уменьшается;
2) повышается;
3) повышается до определенного значения;
4) не изменяется.
ОТВЕТЫ
| Тема № 1.1 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 1.2 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 1.3 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ |
| Тема № 1.4 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема №1.5 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 1.6 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | Li2O | |||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ |
| Тема № 1.7 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.1 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.2 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ |
| Тема № 2.3 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.4 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.5 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.6 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.7 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.8 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.9 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.10 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.11 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.12 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 2.13 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 3.1 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 3.2 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 3.3 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 3.4 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ | ||||||||||||||||||||||||||||||
| Тема № 3.5 | ||||||||||||||||||||||||||||||
| Вопрос | ||||||||||||||||||||||||||||||
| Ответ |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 Клименко А.И. Практика тестирования. – М.: Профиздат, 1991. – 80 с.
2 Хубаев Г. О построении шкалы оценок в системе тестирования// Высшее образование в России. – 1996.- № 1 – С. 122-125.
3 Челышкова М.Б. Разработка педагогических тестов на основе современных математических моделей: Уч. пособие. – М., 1995. - 60 с.
4 Отчет о проведении централизованного тестирования выпускников общеобразовательных учреждений России в 1996 году. – М., 1996. – 117 с.
Сборник тестовых заданий обсужден и рекомендован к изданию на заседании кафедры "Химия". Протокол № 5 от 29 января 2000 г.
Редактор Н.В.Суева
Зав. библиотекой А.П.Доманова
Нормоконтроль З.И.Бондарева
Ответственный за выпуск Н.В.Ковбасюк
ЛР № от 2000 г. Подписано в печать
Печать оперативная. 1 уч.-изд.л. Тираж экз. Заказ №
ЮРГУЭС. Лаборатория оперативной печати.
346500, г. Шахты, Ростовская область, ул. Шевченко, 147.
Выписка
|
Просмотров 1432 |
|
|
