
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Химическая связь и строение молекул. Валентность и
|
|
Степень окисления
1 Образование молекулы HCl объясняется перекрыванием электронных
облаков:
1) s и s; 2) s и d; 3) s и p; 4) p и d.
2 Водородная связь образуется между молекулами:
1) СН4; 2) HF; 3) HI; 4) H2Se.
3 Молекула СН4 гибридизована по типу:
1) sp3; 2) sp2 ; 3) sp; 4) sp3d2.
4 Молекула ВСl3 имеет форму:
1) линейную; 2) плоского треугольника;
3) тетраэдрическую; 4) октаэдрическую.
5 Преимущественно ионная связь реализуется в соединении:
1) ВеСl2; 2) AlCl3; 3) CsCl; 4) CCl4.
6 Парамагнитными свойствами обладает молекула:
1) NH3; 2) CO; 3) O2; 4) F2.
7 Молекула AlCl3 гибридизована по типу:
1) sp; 2) sp2; 3) sp3; 4) sp3d2.
8 При образовании иона [Zn(H2O)4]2+ реализуется связь:
1) ковалентная; 2) ионная;
3) донорно-акцепторная; 4) водородная.
9 Соединения только с ионной связью находятся в ряду:
1) CaO, H2S, O2, NaCl; 2) NaCl, CaO, Al2S3, KI;
3) O2, HCl, ZnO, KCl; 4) N2, NH3, CaO, H2S.
10 Донорно-акцепторная связь реализуется в соединении:
1) NaCl; 2) Cl2; 3) HCl; 4) NH4Cl.
11 Число электронных пар в молекуле азота:
1) 2; 2) 3; 3) 4; 4) 1.
12 Число s-связей в молекуле азота:
1) 2; 2) 3; 3) 1; 4) 4.
13 Число p-связей в молекуле азота:
1) 2; 2) 3; 3) 1; 4) 4.
14 Донорно-акцепторный механизм ковалентной связи реализуется в:
1) KCl; 2) CCl4; 3)  ; 4) CO2.
; 4) CO2.
15 Молекула, гибридизованая по типу sp3, имеет структуру:
1) линейную; 2) плоскую;
3) тетраэдрическую; 4) октаэдрическую.
16 Молекула О2 имеет кратность связи:
1) 1,5; 2) 2; 3) 2,5; 4) 3.
17 Энергия диссоциации связи в ряду N2 - O2 - F2:
1) убывает; 2) возрастает;
3) убывает, затем возрастает; 4) не изменяется.
18 Ковалентная полярная связь реализуется в соединении:
1) NaCl; 2) I2; 3) HF; 4) Cl2.
19 Ионная связь имеет место в соединении:
1) СО; 2) КF; 3) SO2; 4) Н2O.
20 Металлическая связь образуется в соединении:
1) I2; 2) Fe; 3) P; 4) CuCl2.
21 Cтепень окисления (0) и валентность (I) имеет хлор в соединении:
1) НСl ; 2) Cl2; 3) HClO; 4) NaCl.
22 Степень окисления (-1) и валентность (I) имеет хлор в соединении:
1) HCl; 2) Cl2; 3) Cl2O7; 4) HClO.
23 Степень окисления (0) и валентность (III) имеет азот в соединении:
1) NO; 2) NO2; 3) N2; 4) N2O.
24 Cтепень окисления (-3) и валентность (III) имеет азот в соединении:
1) NH3; 2) NO; 3) N2; 4) N2O.
25 Донорно-акцепторный механизм связи реализуется в:
1) F2; 2) HF; 3)  ; 4) BF3.
; 4) BF3.
26 Ковалентная полярная связь реализуется в соединении:
1) Н2; 2) Н2О; 3) О2; 4) О3.
27 Более устойчивой является молекула:
1) H2S; 2) H2O; 3) H2Te; 4) H2Po.
28 В образовании связей участвует одна электронная пара в ряду:
1) Cl2 и Н2; 2) Сl2 и О2; 3) О2 и N2; 4) Cl2 и N2.
29 Cтепень окисления элемента равная (0), а валентность (III) имеет место в
соединении:
1) О2; 2) BF3; 3) N2; 4) NH3.
30 Металлическая связь осуществляется в веществе:
1) I2(к); 2) P4(к); 3) S8(к); 4) Cu(к).
30 Степень окисления и валентность азота по абсолютной величине равны в
соединении:
1) N2; 2) NH3; 3) HNO3; 4) NH4Cl.
32 Степень окисления атома углерода (-1) имеет место в соединении:
1) CCl4; 2) CH3OH; 3) CH3COOH; 4) CH3COH.
33 В молекуле NF3 реализуется тип связи:
1) ковалентная полярная; 2) ковалентная неполярная;
3) ионная; 4) донорно-акцепторная.
34 По донорно-акцепторному механизму протекает реакция:
1) CuSO4 + NH4OH ®; 2) N2 + H2 ®;
3) CaO + CO2 ®; 4) HNO3 + KOH ®.
•35 Только s-связи реализуются в соединении:
1) СО2; 2) N2; 3) NH3; 4) C2H4.
36 p-cвязи имеют место в соединении:
1) HCl; 2) C2H4; 3) Cl2; 4) H2O.
37 Прочность связи в ряду: 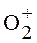 ® О2 ®
® О2 ®  :
:
1) уменьшается; 2) возрастает;
3) не изменяется; 4) уменьшается, затем возрастает.
38 Парамагнитными свойствами обладает молекула:
1) F2; 2) N2; 3) C2; 4) O2.
39 Диамагнитными свойствами обладает молекула:
1) О2; 2) В2; 3) С2; 4) О2+.
40 Одинаковой прочностью обладает пара молекул:
1) СО и N2; 2) CO и С2; 3) В2 и С2; 4) N2 и Н2.
|
Просмотров 1490 |
|
|
