
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Растворы. Электролитическая диссоциация
|
|
Гидролиз солей
1 Средняя соль получится при действии . . . на Bi(OH)2NO3
1) NaOH; 2) HNO3; 3) Cu(NO3)2 4) KOH.
2 Cредняя соль получится при действии . . . на KHSO4
1) KOH; 2) H2SO4; 3) NaHSO4; 4) SO3.
3 Продуктом диссоциации фосфорной кислоты по II ступени будут ионы:
1) Н+, Н2РО4 -; 2) Н+, НРО42-; 3) Н+, РО43-; 4) Н2О, Р2О5.
4 Продуктом диссоциации гидрофосфата калия будут ионы:
1) К+, Н+, РО43-; 2) К+, РО43-; 3) К+, Н2РО4 -; 4) К+, НРО42-.
5 Продуктом диссоциации гидроксохлорида алюминия будут ионы
1) Al3+, OH–; 2) (AlOH)2+, Cl–; 3) Al(OH)2+, Cl–; 4) Al3+, Cl–, OH–.
6 Продуктом диссоциации NH4Fe(SO4)2 , будут ионы
1) NH4+, SO42-; 2) Fe3+, SO42-;
3) NH4+, Fe3+, SO42-; 4) [NH4Fe]4+, SO42-.
7 Продуктом первичной диссоциации соли [Cr(H2O)2(NH3)4]Cl3 будут ионы
1) [Cr(H2O)2(NH3)4]3+, Cl; 2) Cr3+, H2O;
3) Cr3+, NH3 ; 4) Cr3+, H2O, NH3, Cl-.
8 Продуктом диссоциации фосфорной кислоты по I ступени будут ионы:
1) Н+, Н2РО4–; 2) Н+, НРО42–; 3) Н+, РО43–; 4) Н2О, Р2О5.
9 Продуктом диссоциации дигидрофосфата калия будут ионы:
1) К+, Н+, РО43–; 2) К+, РО43– ; 3) К+, Н2РО4–; 4) К+, НРО42–.
10 Продуктом диссоциации дигидроксохлорида алюминия будут ионы:
1) Al3+, OH–; 2) (AlOH)2+, Cl–; 3) Al(OH)2+, Cl–; 4) Al3+, Cl-, OH–.
11 Указать реакцию, протекающую до конца:
1) ВаCl2 + Na2SO4 ®; 2) HCl + NaNO3 ®;
3) Cu + NaOH ®; 4) K2SO4 +HCl ®.
12 Ионным уравнением Ва2+ + SO42- = BaSO4 выражается реакция:
1) ВаО + Н2SO4 ®; 2) BaCl2 + Na2SO4®;
3) Ba + H2SO4 ®; 4) BaO + SO3 ®.
13 Указать ионы, которые могут совместно находиться в растворе:
1) Na+ и ОН- 2) Zn2+ и ОН-
3) Сu2+ и ОН- 4) Al3+ и ОН-.
14 Кислые соли не образует кислота:
1) Н2СО3; 2) HNO3; 3) H2S; 4) H3PO4.
15 Ионным уравнением Cu2+ + 2OH- ® Cu(OH)2 выражается реакция:
1) СuO + H2O ®; 2) CuCl2 + NaOH ®;
3) CuS + HCl ®; 4) CuCl2 + NH4OH ®.
16 Ионным уравнением Са2+ + СО32- = СаСО3 выражается реакция:
1) СаCl2 + H2CO3 ®; 2) CaSО3 + Na2CO3 ®;
3) CaCl2 + Na2CO3 ®; 4) CaO + CO2 ®.
17 Из оксидов: CuO, Li2O, Cr2O3 с водой реагирует . . .
18 Массовая доля (%) соли в растворе, содержащем 50 г соли и 200 г воды равна
1) 50; 2) 20; 3) 10; 4) 15.
19 Молярность раствора, содержащего 40 г NaOH в 0,5 л раствора равна:
1) 2; 2) 1; 3) 0,5; 4) 1,5.
20 Моляльность раствора, содержащего 0,1 моль NaCl в 200 г воды равна:
1) 1; 2) 0,5; 3) 0,2 ; 4) 1,5.
21 Щелочную реакцию имеет раствор:
1) хлорид натрия; 2) хлороводород;
3) карбонат натрия; 4) хлорид аммония.
22 Лакмус примет красную окраску в растворе:
1) Na2CO3; 2) KCl; 3) NiCl2; 4) KHS.
23 Нейтральную среду в водном растворе имеет:
1) СН3СООNa; 2) Na2SO3; 3) NH4Cl; 4) K2SO4.
24 Указать ряд солей, гидролизующихся по аниону:
1) Li2CO3, NiCl2; 2) Na2S, K2SO3;
3) FeCl3, Cu(NO3)2; 4) K3PO4, CrCl3.
25 Указать ряд солей, гидролизующихся по катиону:
1) FeCl3, Zn(NO3)2; 2) NaI, K2S;
3) Na3PO4, Co(NO3)2; 4) NH4NO3, Al2S3.
26 Указать ряд солей, гидролизующихся по катиону и аниону:
1) Na2CO3, KNO3; 2) (NH4)2S, Al2(CO3)3;
3) Li2S, Na2CO3; 4) CuSO4, CrCl3.
27 Полному гидролизу подвергается соль:
1) NaNO3; 2) Na2CO3; 3) K2SO4; 4) Cr2S3..
28 Интенсивность окраски фенолфталеина в растворе ацетата натрия при
нагревании:
1) усилится; 2) ослабеет; 3) не изменится.
29 Указать продукт гидролиза I ступени NiCl2:
1) NiOHCl, HCl; 2) Ni(OH)2, HCl;
3) NiOHCl, H2O; 4) Ni(OH)2, H2O.
30 Указать продукт гидролиза фосфата калия по II ступени:
1) К2НРО4, КОН; 2) КН2РО4, Н3РО4;
3) КН2РО4, КОН; 4) К2НРО4, Н3РО4.
31 Указать продукты полного гидролиза карбоната алюминия:
1) Al(OH)3, H2O, CO2; 2) AlOHCO3, H2O, CO2;
3) AlOHCO3, Al(OH)3, CO2; 4) [Al(OH)2]2CO3, H2O, CO2.
32 Дополнить уравнение гидролиза в ионной форме
. . . ® Fe(OH)2+ + H+
1) FeOH2+, H2O; 2) Fe3+, H2O;
3) Fe(OH)3, H2O; 4) Fe2+, OH–.
33 Дописать продукты II ступени гидролиза
CrOH(NO3)2 + H2O ® . . .
1) Cr(OH)3,HNO3; 2) Cr(OH)2NO3, HNO3;
3) Cr(NO3)3, H2O; 4) Cr(OH)3, H2O.
34 Добавление HCl сместит равновесие в реакции
CuCl2 + H2O 
 CuOHCl + HCl
CuOHCl + HCl
1) вправо; 2) влево; 3) не сместит.
35 Добавление NaOH cместит равновесие в реакции
Zn(NO3) + H2O  ZnOHNO3 + HNO3
ZnOHNO3 + HNO3
1) вправо; 2) влево; 3) не сместит.
36 Ослабит гидролиз хлорида железа (III) добавление
1) хлороводородной кислоты; 2) гидроксида натрия;
3) воды; 4) сульфата железа (III).
37 Численное значение рН раствора уменьшится при добавлении к воде:
1) K2S; 2) ZnSO4; 3) NaOH; 4) NaCl.
38 Численное значение рН увеличится при добавлении к воде:
1) NaCl; 2) AlCl3; 3) HCl; 4) Na2CO3.
39 Катионы водорода образуются при диссоциации вещества:
1) H2SO4; 2) NaHS; 3) CuOHCl; 4) H2S.
40 Гидроксид-ион образуется при диссоциации:
1) CuOHCl; 2) Ba(OH)2; 3) Al(OH)3; 4) HCl.
41 Жесткость воды определяется формулой:
1) 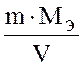 ; 2)
; 2)  ; 3)
; 3)  ; 4) m × V ×Mэ
; 4) m × V ×Mэ
42 Временная жесткость воды обусловлена присутствием солей:
1) Са(НСО3)2, Мg(НСО3)2; 2) NaHCO3, KHCO3;
3) CaCO3, MgCO3; 4) Na2CO3, K2CO3.
43 Постоянная жесткость воды обусловлена присутствием солей:
1) сульфатов и хлоридов натрия и калия;
2) сульфатов и хлоридов кальция и магния;
3) карбонатов натрия и калия;
4) гидрокарбонатов кальция и магния.
44 Временная жесткость устраняется действием:
1) Na2SO3; 2) NaCl; 3) Cu(OH)2; 4) кипячение.
45 Постоянная жесткость воды устраняется действием:
1) кипячение; 2) Cr(OH)3; 3) Na2CO3; 4) Na2SO4.
|
Просмотров 2189 |
|
|
