
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Определение общей жесткости водопроводной и минеральной воды
|
|
Краткое теоретическое вступление: Общая жесткость воды характеризуется суммарным содержанием солей кальция и магния и определяется комплексонометрически с индикатором эриохром черный-Т.
Цель: Определить общую жесткость воды.
Реактивы: 0,05 н комплексон -3,
аммонийный буфер с рН 9,5-10
Ход выполнения: Отбирают мерной колбой на 100 мл исследуемой воды в колбу для титрования, добавляют цилиндром 10 мл аммонийного буфера, микрошпатель индикатора эриохрома черного и титруют 0,05 н раствором ЭДТА до изменения окраски в синюю. Титрования проводят до сводимых результатов.
Обработка результатов:
Общая жесткость воды вычисляют по формуле:

Где: с(ЭДТА) – нормальная концентрация раствора комплексона -3;
V(ЭДТА) – средний объем комплексона – 3, пошедший на титрования воды;
Vа – объем воды, взятой на титрования
Выводы: сделать вывод об общей жесткости исследуемой воды.
Лабораторная работа.
Определение массовых долей ионов кальция и магния при совместном присутствии в растворе
Краткое теоретическое вступление: Определение основано на титровании раствора, содержащего ионы кальция и магния, стандартным раствором ЭДТА с двумя индикаторами - эриохромом черным Т и мурексидом. С эриохромом черным Т титруется сумма кальция и магния; затем с мурексидом в щелочной среде - только кальций. Разность объемов, затраченных на титрование смеси с разными индикаторами,, соответствует содержанию магния в растворе.
Цель: определить содержание кальция и магния.
Реактивы:Этилендиаминтетраацетат натрия двузамещенный - 0,05н раствор;
Аммиачный буферный раствор;
Гидроксид натрия NaOH - 20%-й раствор;
Эриохром черный Т (кр.). Мурексид (кр.).
Ход выполнение.Анализируемый раствор в мерной колбе вместимостью 100 мл разбавляют водой до метки, перемешивают и отбирают пипеткой 10 мл раствора для титрования.
В первой пробе определяют сумму кальция и магния. Для этого разбавляют раствор в колбе для титрования 70-80 мл дистиллированной воды, добавляют 5 мл аммиачного буферного раствора и индикатора эриохрома черного Т до образования винно-красной окраски. После этого медленно титруют 0,05 н раствором ЭДТА до изменения окраски из винно-красной в синюю (V1).
К другой пробе прибавляют 70-80 мл воды, 2 мл 20%-го раствора NaOH и индикатора мурексида до образования красной окраски. Затем титруют 0,05 н раствором ЭДТА до появления фиолетовой окраски. Затраченный объем ЭДТА соответствует содержанию кальция (V2).
Обработка результатов:
| V1(ЭДТА) при титровании с эриохромом | V2(ЭДТА) при титровании с мурексидом |
| … | … |
| … | … |
| … | … |
Массу кальция и магния в растворе рассчитывают по формулам:

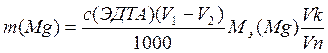
Где: с(ЭДТА) – нормальная концентрация раствора комплексона -3;
V1(ЭДТА) – средний объем комплексона – 3, пошедший на титрования кальция и
магния;
V2(ЭДТА) – средний объем комплексона – 3, пошедший на титрования кальция;
Vк – объем колбы;
Vп – объем аликвоты.
Выводы:
Лабораторная работа
|
Просмотров 1547 |
|
|
