
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Определение кислотности хлеба
|
|
Краткое теоретическое вступление. Кислотность хлеба обусловливается наличием в нем, главным образом, молочной и уксусной кислот, которые образуются при брожении теста. Умеренная кислотность способствует лучшему усвоению хлеба и придает ему приятный вкус. Большая кислотность хлеба вредна, так как может повысить процессы брожения в органах пищеварения.
За один градус кислотности хлеба принимают 1 мл 1 н. раствора NaOH, израсходованного на нейтрализацию кислот в 100 г хлеба.
Кислотность ржаного хлеба не должна превышать 12°, а пшеничного -70.
Качество хлебобулочных изделий
| Наименование изделий | Влажность, % не более | Кислотность, град | Пористость, % не менее |
| Хлеб ржаной простой | 51,0 | ||
| Хлеб бородинский подовый | 46,0 | ||
| Хлеб пшеничный | 48,0 | ||
| Булки городские | 41,0 | 2,5 | |
| Изделия хлебобулочные плетеные | 41,0 | 2,5 | |
| Батоны | 43,0 | 3,0 | |
| Сайки | 43,0 | 3,0 | |
| Хлеб домашний | 43,0 | 3,0 | |
| Батоны нарезные | 36,0 | 4,0 |
Химизм:
Взаимодействие гидроксида натрия с. молочной и уксусной кислотами:
СН3СН(ОН)СООН + NaOH = CH3CH(OH)COONa + Н2О
СН3СООН + NaOH = CH3CООNa + Н2О
Цель: Определить кислотность хлеба
Ход выполнения:
Поместите 50 г измельченной хлебной мякоти в стакан на 500 мл. Налейте в него 200 мл теплой дистиллированной воды, смесь тщательно размешайте, а затем добавьте еще 50 мл воды. Оставьте приготовленную смесь на 45-50 мин для отстаивания (в течение первых 30 мин смесь три раза тщательно взболтайте). После этого из верхнего слоя отберите в коническую колбу на 50 мл отстоявшейся жидкости (хлебная вытяжка). Прибавьте в коническую колбу 2-3 капли индикатора фенолфталеина и титруйте раствором NaOH до появления слаборозовой окраски, не исчезающей в течение 1 мин. Результаты рассчитайте в градусах кислотности.
Обработка результатов:
Общий объем хлебной вытяжки V=
Объем аликвотной части раствора (хлебной вытяжки) Va=
Масса хлебной мякоти m=
Объем NaOH, пошедший на титрование VNa0H=.
Расчет кислотности:
Пересчет на 1,0 н раствор NaOH: 
Объем 1,0 н NaOH необходимый на титрование 250 мл вытяжки: 
На 100 г продукта потребуется:

Выводы:сделать выводы о соответствии кислотности хлебобулочных изделий с табличными данными.
Определение кислотности молока.
Краткое теоретическое вступление. Молоко, сразу после доения, имеет нейтральную реакцию среды. Постоявшее молоко дает кислую реакцию, которая постепенно возрастает, так что по степени кислотности молока можно судить о его свежести.
Кислотность молока определяют в градусах Тернера. За один градус кислотности по Тернеру принимают 1 мл 0,1 н. раствора NaOH, израсходованного на нейтрализацию кислот в 100 мл молока.
Различное по качеству молоко имеет следующую кислотность (в градусах по Тернеру):свежее - 16° - 22°; несвежее - 23° и выше; разбавленное - ниже 16°; с примесью соды - ниже 16°; поступающее в продажу - не выше 21°.
Цель: Определить кислотность молока
Ход выполнения:
Поместите 10 мл исследуемого молока и 20 мл дистиллированной воды в коническую колбу. Прибавьте 4-5 капель индикатора фенолфталеина, хорошо перемешайте и титруйте раствором NaOH, до появления слаборозовой окраски, не исчезающей в течение 2 мин. Титрование повторите не менее трех раз, до получения хорошо сходимых результатов.
Обработка результатов:
Результаты рассчитайте в градусах кислотности по Тернеру.
Объем молока Vа=
Объемы NaOH, пошедшие на титрование VNa0H=
Пересчет на 0,1 н NaOH: 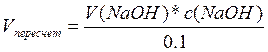
Объем 0,1н NaOH необходимый на титрование 100мл молока: 
Кислотность = V100
Выводы: По полученным данным определить свежесть молока.
Лабораторная работа.
Контрольная задача:
«Определение содержания щелочи и соды при совместном присутствии»
Краткое теоретическое вступление. Определение основано на титровании смеси NaOH и Na2CO3 стандартным раствором хлороводородной кислоты с двумя индикаторами - фенолфталеином и метиловым оранжевым, применяемыми последовательно.
При титровании раствора, содержащего эти вещества, хлороводородной кислотой в присутствии фенолфталеина происходят реакции
NaOH + НС1 = NaCl + Н2О,
Na2CO3+ НС1 = NaHCO3 + NaCl.
Обесцвечивание фенолфталеина указывает на то, что обе реакции полностью завершились, и вместо исходных веществ в растворе имеются NaCl и NaHCO3. Бесцветный раствор, содержащий NaHCO3, имеет слабощелочную реакцию, при добавлении метилового оранжевого он окрашивается в желтый цвет, и если продолжить титрование кислотой, будет происходить реакция
NaHCO3 + НС1 = NaCl + Н2СО3.
Изменение желтой окраски на оранжевую свидетельствует о том, что реакция полностью закончилась.
Разность объемов хлороводородной кислоты (Vм.о(HCl) – Vф-ф(HCl)), затраченных на титрование смеси с метиловым оранжевым и фенолфталеином, соответствует половине количества карбоната натрия, присутствующего в растворе. Удваивая эту разность, получают объем кислоты, эквивалентный количеству всего карбоната. Вычитая указанную разность из объема Vф-ф(HCl) израсходованного на титрование смеси NaOH и Na2CO3 с фенолфталеином, находят объем кислоты, эквивалентный количеству ; гидроксида натрия.
Цель: определить массу гидроксида натрия и карбонат натрия в контрольной задачи.
Ход выполнение. Анализируемый раствор в мерной колбе вместимостью 100 мл разбавляют до метки свеже прокипяченной и охлажденной под краном дистиллированной водой. Пипетку вместимостью 10 мл 2-3 раза ополаскивают этим раствором, после чего дозируют аликвоту в коническую колбу вместимостью 250-300 мл, добавляют 3-5 капель 0,1%-го раствора фенолфталеина и быстро титруют кислотой, чтобы избежать заметного поглощения углекислого газа из воздуха. Под конец титрант добавляют по каплям до обесцвечивания. Записывают отсчет по бюретке (Vф-ф(HCl)), прибавляют в колбу 1-2 капли метилового оранжевого и продолжают титрование до перехода окраски из желтой в оранжевую. Производят второй отсчет по бюретке (Vм.о(HCl)).
Обработка результатов:
Массу каждого из компонентов анализируемой смеси рассчитывают по формулам:


Выводы: рассчитывают ошибку в определении массы гидроксида натрия и карбоната натрия.
Лабораторная работа
Анализ лекарственных форм
Цель: количественно определить сколько данного чистого лекарственного средства находится в препарате, и сравнить с теоретическими данными.
Краткое теоретическое вступление:
Дибазол (папазол, андипал) - белый или белый со слегка сероватым или желтоватым оттенком кристаллический порошок, горько - соленого вкуса. Гигроскопичен. Температура плавления 182-186 °С. Трудно растворим в воде, легко - в спирте, трудно или практически нерастворим в других органических растворителях.

Ход выполнения:
Ацидиметрическое определение дибазола после выделения основания. К точной навеске порошка (0,1г) прибавляют 2 мл 0,1 н. раствора серной кислоты и по каплям 3% раствор перманганата калия в 0,5 н. растворе серной кислоты до стойкого розового окрашивания (на водяной бане при температуре 60 °С). Избыток перманганата калия разлагают путём прибавления 1-2 капель 5% раствора щавелевой кислоты. Раствор количественно переносят в делительную воронку, добавляют небольшими порциями гидрокарбонат натрия до щелочной реакции на лакмус и основание дибазола извлекают хлороформом (3 раза по 15 мл), хлороформные извлечения фильтруют через безводный сульфат натрия, хлороформ удаляют, остаток растворяют в 2-3 мл спирта, добавляют 20 мл воды и титруют из полумикропипетки 0,1 н. раствором соляной кислоты до розового окрашивания, индикатор - метиловый оранжевый 1 мл 0,1 н. раствора соляной кислоты соответствует 0,02447 г дибазола.
Прямое алкалиметрическое определение дибазола. 0,15 г препарата (точная навеска) растворяют в 10 мл предварительно нейтрализованного по фенолфталеину спирта и титруют с тем же индикатором 0,1 н. раствором едкого натра до слаборозового окрашивания.
1 мл 0,1 н. раствора едкого натра соответствует 0,02447 г дибазола, которого в препарате должно быть не менее 99,0% в пересчёте на сухое вещество:

Обработка результатов:
V1Na0H(HCl) =
V2Na0H(HCl) =
V3Na0H(HCl) =
m(навески)=
Сделать пересчет на 0,1н раствор (NaOH или HCl):

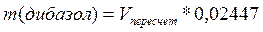

Выводы:
Кислота аскорбиновая.
Ход выполнения:
Растворяют 0,5г таблетки или 0,05 г порошка в 10-20 мл воды и титруют 0,1 моль/л раствором гидроксида натрия до розового окрашивания (индикатор – фенолфталеин). 1 мл 0,1 М гидроксида натрия соответствует 0,0176 г аскорбиновой кислоты.
Обработка результатов:
V1Na0H =
V2Na0H =
V3Na0H =
m(навески)=
Сделать пересчет на 0,1н раствор (NaOH):
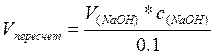
m(аск. к-ты) = Vпересчет*0,0176

Выводы:
Кислота никотиновая.
Ход выполнения:
Растворяют 0,2 г порошка в 20 мл воды и титруют 0,1 н раствором гидроксида натрия до розового окрашивания (индикатор – фенолфталеин). 1 мл 0,02 М гидроксида натрия соответствует 0,002462 г никотиновой кислоты.
Обработка результатов:
V1Na0H =
V2Na0H =
V3Na0H =
m(навески)=
Сделать пересчет на 0,02 н раствор (NaOH):

m(ник. к-ты) = Vпересчет*0,002462

Выводы:
Краткое теоретическое вступление:
Аспирин (кислота ацетилсалициловая)
С9Н8О4 М. в. 180.16

Бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом, слабокислого вкуса. Препарат устойчив в сухом воздухе, во влажном постепенно гидролизуется с образованием уксусной и салициловой кислот. Мало растворим в воде, легко растворим в спирте, растворим в хлороформе, эфире, в растворах едких и углекислых щелочей.
Ход выполнения:
Около 0,3 г порошка растертых таблеток взбалтывают с 10 мл спирта в течении 10 минут. Титруют 0,1 н гидроксидом натрия до розовой окраски (индикатор – фенолфталеин). 1 мл 0,1М гидроксида натрия соответствует 0,01802 г С9Н8О4, которого в препарате должно быть не менее 99,5% в пересчёте на сухое вещество.
Обработка результатов:
V1Na0H =
V2Na0H =
V3Na0H =
m(навески)=
Сделать пересчет на 0,1н раствор (NaOH):
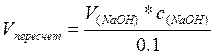
m(аспирина) = Vпересчет*0,01802

Выводы:
КАЛЕНДАРНЫЙ ПЛАН
лабораторно-практических занятий по курсу «Аналитическая химия» для студентов
II курса специальность «фармация» на II семестр
2006/2007 учебного года
| №п/п | Содержание занятий | Кол-во Часов |
| 1. | Осадительное титрование Анализ лекарственных форм Определение массовой доли натрия хлорида в изотоническом растворе | |
| 2. | Осадительное титрование Анализ пищевых продуктов Определение хлорида натрия в колбасных изделиях методом Мора* | |
| 3. | Комплексонометрическое титрование Определение общей жесткости природной воды* | |
| 4. | Комплексонометрическое титрование Лабораторная работа Определение массовых долей ионов кальция и магния при совместном присутствии* | |
| 5. | Комплексонометрическое титрование Анализ косметических средств Определение кальция в зубной пасте* | |
| 6. | Коллоквиум Методы осаждения и комплексонометрии | |
| 7. | Перманганатометрия Анализ лекарственных форм Контрольная задача Определение перекиси водорода в растворе. Оформление задачи и ее защита* Решение задач | |
| 8. | Окислительно-восстановительное титрование Дихроматометрия Лабораторная работа Определение Fe2+в сульфате железа (II).* | |
| 9. | Коллоквиум Окислительно-восстановительное титрование | |
| 10. | Физико-химические методы анализа Оптические методы анализа Анализ лекарственных форм Определение массовой доли ионов железа (III) в железоаммонийных квасцах методом фотоколориметрии.* | |
| 11. | Физико-химические методы анализа Оптические методы анализа Анализ лекарственных форм Определение концентрации глюкозы в водных растворах, методом рефрактометрии* | |
| 12. | ||
| 13. | Физико-химические методы анализа Электрохимические методы анализа Контрольная задача Определение содержания нитрат-ионов в твердой пробе методом ионометрии с помощью нитрат-селективного электрода. | |
| 14. | Потенциометрическое определение константы диссоциации уксусной кислоты | |
| 15. | Кондуктометрическое титрование смеси соляной и уксусной кислот | |
| 16. | Физико-химические методы анализа Ионообменная хроматография Контрольная задача Определение содержания соли в растворе с применением катионита или анионита* | |
| 17. | Физико-химические методы анализа Хроматография Анализ лекарственных форм Идентификация фурацилина методом тонкослойной хроматографии. | |
| 18. | Коллоквиум. Электрохимические и Хроматографические методы анализа.Оптические методы анализа | |
| 19. | Защита лаборатоных работ. | |
| 20. | ||
| Всего: | 76 часов |
Осадительное титрование.
Лабораторная работа
|
Просмотров 4200 |
|
|
