
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Гибридизация электронов углерода. s- и p- связи
|
|
При изучении природы ковалентных связей атомов углерода пришлось сделать допущение, что валентные электроны в процессе образования химических связей располагаются не на чистых s- и р-орбиталях, а на смешанных (гибридных) орбиталях. Это явление получило название гибридизации.При образовании молекулы метана

углерод тратит на образование связей один s-электрон и три р-электрона. Одна из этих связей должна быть менее прочной, т.к. перекрывание s-орбиталей углерода с s-орбиталью водорода будет меньшим, чем перекрывание р-орбитали углерода с s-орбиталью водорода. В действительности, данная структурная формула показывает, что все четыре связи Н-С в молекуле метана равноценны, т.е. четыре электрона углерода при образовании химических связей распределяются на 4-х одинаковых "гибридных" орбитах (явление sр3-гибридизации). Путем математической обработки параметров атомных орбиталей при соблюдении принципов квантовой химии были рассчитаны гибридизованные орбиты. Они имеют направленный характер и более выгодны геометрически для образования связей, так как эффективнее перекрываются с орбитами электронов других атомов и образуют более прочные связи.
sp3-гибридзация наблюдается при образовании углеродом 4-х простых связей. Наиболее устойчивое расположение гибридных орбиталей такое, когда оси электронных облаков направлены из центра тетраэдра к его вершинам, то есть располагаются под углами 109о28/ (тетраэдрическое строение). При этом силы отталкивания электронов наименьшие.




Рисунок 3
Электронное строение молекулы метана
Область максимального перекрывания электронной плотности при образовании связей совпадает с прямой, соединяющей ядра атомов. Такие связи называются s-связями, а электроны, их образующие, - s-электронами.
При образовании двойной связи каждый атом углерода соединяется с тремя другими атомами
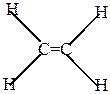
поэтому гибридизуются три электрона углерода – один s-электрон и 2 р-электрона (sр2-гибридизации). Наиболее симметричное расположение 3-х sp2-гибридных орбит достигается при размещении их осей в одной плоскости под углом 120о друг к другу (плоскостно-тригональная структура). Химические связи. образующиеся при взаимодействии гибридных орбиталей друг с другом и с s-электронами водорода, относятся к s-связям.
 |


Рисунок 4
Электронное строение молекулы этилена
р-орбиталь углерода, не участвующая в гибридизации, располагается перпендикулярно плоскости, на которой находятся ядра атомов. В результате бокового перекрывания негибридизованных
р-орбиталей выше и ниже плоскости s-связей образуется вторая связь между атомами углерода. Такой вид связи получил название p-связи. Электроны, ее образующие, называются p-электронами.
При образовании тройной связи атом углерода соединяется только с двумя другими атомами Н-С  С-Н. Поэтому гибридизуются только два электрона: один s-электрон и один р-электрон (sp-гибридизация). Два гибридных облака, симметрично расположенные под углом 180о друг к другу, образуют s-связи. Оставшиеся два р-электрона располагаются под углом 90о друг к другу и к оси s-связей. При их боковом перекрывании образуются две p-связи.
С-Н. Поэтому гибридизуются только два электрона: один s-электрон и один р-электрон (sp-гибридизация). Два гибридных облака, симметрично расположенные под углом 180о друг к другу, образуют s-связи. Оставшиеся два р-электрона располагаются под углом 90о друг к другу и к оси s-связей. При их боковом перекрывании образуются две p-связи.






Рисунок 5
Электронное строение молекулы ацетилена
Таким образом, в органических соединениях углерод может существовать в трех состояниях: sp3, sp2, sp-гибридизациях. s -электроны прочно связаны с ядром, поэтому s-связь отличается высокой прочностью и малой поляризуемостью. p –электроны слабее связаны с ядрами атомов,
p-связи отличаются малой прочностью и высокой поляризуемостью.
|
Просмотров 803 |
|
|
