
Главная Обратная связь
Дисциплины:
Архитектура (936)
Биология (6393)
География (744)
История (25)
Компьютеры (1497)
Кулинария (2184)
Культура (3938)
Литература (5778)
Математика (5918)
Медицина (9278)
Механика (2776)
Образование (13883)
Политика (26404)
Правоведение (321)
Психология (56518)
Религия (1833)
Социология (23400)
Спорт (2350)
Строительство (17942)
Технология (5741)
Транспорт (14634)
Физика (1043)
Философия (440)
Финансы (17336)
Химия (4931)
Экология (6055)
Экономика (9200)
Электроника (7621)

Отличие в физических и химических свойствах фторуглеводородов
|
|
Монофторуглеводороды токсичны и сравнительно малоустойчивы, легко отщепляют HF, могут давать реакции замещения фтора, если же ввести два или более атома фтора к одному углеродному атому, то в результате понижается токсичность и резко повышается их устойчивость. Особенно это относится к полностью фторированным углеводородам, которые обладают следующими особенностями:
1) совершенно не токсичны;
2) не изменяются при нагревании до 400-5000С и только при красном пламени разлагаются на CF4 и C;
3) не изменяют своих свойств при низких температурах –50 - +700С;
4) не подвергаются действию концентрированных кислот, щелочей и даже царской водки;
5) не подвергаются инициированному окислению кислородом (т.е.не старятся);
6) не подвергаются разрушительному действию бактерий;
7) обладают очень малой адгезией, т.к. имеют незначительные силы межмолекулярного взаимодействия.
Все эти особенности свойств обуславливаются очень высокой электроотрицательностью фтора и малым объемом атома фтора. Связь C-F сильно поляризована, энергия связи очень велика, а межатомные расстояния малы. Поэтому атомы фтора очень близко расположены друг к другу и полностью экранируют атомы углерода, защищая их от химических воздействий.
ЛЕКЦИЯ 8
СПИРТЫ (ОКСИСОЕДИНЕНИЯ)
Производные углеводородов, получаемые замещением одного или нескольких атомов водорода на группу ОН (окси-группа).
Классификация
1. По строению цепи (предельные, непредельные).
2. По атомности – одноатомные (одна группа ОН), многоатомные (2 и более групп ОН).
3. По положению группы ОН (первичные, вторичные, третичные).
Предельные одноатомные спирты
Общая формула СnH2n+1OH
| Гомологический ряд | Радикально-функциональная номенклатура, карбинальная | |
| СН3ОН | Метиловый спирт, карбинол, метанол | |
| С2Н5ОН | Этиловый спирт, метилкарбинол, этанол | |
| С3Н7ОН | СН3СН2-СН2ОН | Пропиловый спирт, этилкарбинол, 1-пропанол |
| 1 2 СН3-СН-ОН СН3 | Изопропиловый спирт, диметилкарбинол, 2-пропанол | |
| С4Н9ОН | СН3-СН2-СН2-СН2ОН | Бутиловый спирт, пропилкарбонат, 1-бутанол |
| 4 3 2 СН3-СН2-СН-ОН 1СН3 | Вторичный бутиловый спирт, метилэтилкарбинол, 2-бутанол | |
| СН3-СН-СН2-ОН СН3 | Изобутиловый спирт, изопропилкарбинол, 2-метил-1-пропанол | |
| СН3 СН3-С-ОН СН3 | Третичный бутиловый спирт, триметилкарбинол, диметилэтанол |
По систематической номенклатуре (IUPAC) спирты называют по углеводородам, соответствующим самой длинной цепочке углеродных атомов с добавлением окончания “ол”,
6 5 4 3 2 1
СН3-СН-СН2-СН2-СН-СН3 5-метил-2-гексанол
СН3 ОН
Нумерацию начинают с того конца, ближе к которому расположена группа ОН.
Изомерия
1. Структурная – изомерия цепи
изомерия положения окси-группы
2. Пространственная – оптическая, если все три группы у углерода, связанного с группой ОН, разные, например:
С3Н7
СН3-*С-С2Н5
ОН
3-метил-3-гексанол
Получение
1. Гидролиз галоидных алкилов (см. свойства галогенопроизводных).
2. Металлорганический синтез (реакции Гриньяра):
а) первичные спирты получают действием металлорганических соединений на формальдегид:
СН3-MgBr + CH2=O  CH3-CH2-O-MgBr
CH3-CH2-O-MgBr  CH3-CH2OH + MgBr (OH)
CH3-CH2OH + MgBr (OH)
б) вторичные спирты получают действием металлорганических соединений на другие альдегиды:
O
CH3-CH2-MgBr+CH3-C  CH3-CH-CH2-CH3
CH3-CH-CH2-CH3 
H
 CH3-CH-CH2-CH3+MgBr (OH)
CH3-CH-CH2-CH3+MgBr (OH)
в) третичные спирты – действием металлорганических соединений на кетоны:
CH3 CH3
CH3-C-CH3 + H3C-MgBr  CH3-C-CH3
CH3-C-CH3  CH3-C-CH3 + MgBr (OH)
CH3-C-CH3 + MgBr (OH)
O OMgBr OH
третбутиловый спирт
3. Восстановление альдегидов, кетонов:
O H
CH3-C + H2  CH3-C-OH
CH3-C-OH
H H
CH3-C-CH3 + H2  CH3-CH-CH3
CH3-CH-CH3
O OH
изопропиловый спирт
4. Гидратация олефинов (см. свойства олефинов)
Электронное и пространственное строение
Рассмотрим на примере метилового спирта
H
H-C-O-H 1s22s22p2x2py2pz
H
Угол должен быть 900, на деле он 110028/. Причина в высокой электроотрицательности кислорода, который притягивает к себе электронные облака связей С-Н и О-С орбиталей.
Так как у водорода гидроксильной группы его единственный электрон оттянут кислородом, ядро водорода приобретает способность притягиваться к другим электроотрицательным атомам, имеющим неподеленные электроны (атомам кислорода).
Физические свойства
С1-С10 – жидкости, С11 и больше – твердые вещества.
Температура кипения спиртов значительно выше, чем у соответствующих углеводородов, галогенопроизводных и простых эфиров. Это явление объясняется тем, что молекулы спиртов ассоциированы за счет образования водородных связей.
-  +
+ 
:O  H…..:O
H…..:O  H…..:O
H…..:O  H
H
CH3 CH3 CH3
Образуются ассоциаты из 3-8- молекул.
При переходе в парообразное состояние водородные связи разрушаются, на то тратится дополнительная энергия. Температура кипения из-за этого повышается.
Ткип: у первичных > у вторичных > у третичных
Тпл - наоборот: у третичных > у вторичных > у первичных
Растворимость. Спирты растворяются в воде, образуя при этом водородные связи с водой.
С1-С3 – смешиваются неограниченно;
C4-C5 – ограниченно;
высшие – нерастворимы в воде.
Плотность спиртов <1.
Спектральная характеристика спиртов
Дают характерные полосы поглощения в ИК-области. 3600 см-1 (поглощает неассоциированная ОН-группа) и 3200 см-1 (при образовании водородных связей – ассоциированная ОН-группа).
Химические свойства
Обуславливаются наличием группы ОН. Она определяет важнейшие свойства спиртов. Можно выделить 3 группы химических превращений с участием группы ОН.
I. Реакции замещения водорода в окси-группе.
1) Образование алкоголятов
а) действие щелочных металлов и некоторых других активных металлов (Mg, Ca, Al)
C2H5OH + Na  C2H5ONa + H
C2H5ONa + H
этилат натрия
Алкоголяты нацело разлагаются водой с образованием спиртов и щелочи.
C2H5Ona + HOH  C2H5OH + NaOH
C2H5OH + NaOH
б) Реакция Чугаева-Церевитинова – действие магнийорганических соединений.
C2H5OH + CH3MgBr  C2H5OmgBr + CH4
C2H5OmgBr + CH4
Реакция применяется в анализе спиртов для определения количества “подвижного водорода”. В этих реакциях спирты проявляют очень слабые кислотные свойства.
2) Образование сложных эфиров на остаток кислоты – ацил.
а) Реакция этерефикации – взаимодействие спиртов с карбоновыми кислотами.
H2SO4 конц
 - или
- или
 + O HCl газ O
+ O HCl газ O
CH3-C + HO18C2H5  H2O16 + CH3-C
H2O16 + CH3-C
O16H O18-C2H5
уксусно-этиловый эфир
С помощью метода меченых атомов установлено, что реакция этерификации – это замещение ОН-группы на алкоксигруппу. Эта реакция обратима, т.к. образующаяся вода вызывает гидролиз сложного эфира.
б) Ацилирование спиртов ангидридами кислот.
O O
CH3-C H CH3-C
 +O: + :OC2H5
+O: + :OC2H5  OH
OH
CH3-C OC2H5
O CH3-C
 - O
- O
уксусный ангидрид
Эта реакция обратима, т.к. при взаимодействии спирта с ангидридом вода не выделяется (гидролиз не возможен).
в) ацилирование спиртов хлорангидридами кислот
 -
-
 +O O
+O O
СH3-C + HOC2H5  HCl + CH3-C-OC2H5
HCl + CH3-C-OC2H5
Cl:
хлорангидрид
уксусной кислоты
3) Образование простых эфиров
Простые эфиры образуются в результате замещения водорода окси-группы на алкил (алкилирование спиртов).
а) алкилирование галоидными алкилами
C2H5OH + ClCH3  HCl + C2H5OCH3
HCl + C2H5OCH3
б) алкилирование алкилсульфатами или диалкилсульфатами
C2H5OH + CH3O-SO2OH  C2H5OCH3 + H2SO4
C2H5OCH3 + H2SO4
C2H5OH + CH3OSO2OCH3  C2H5OCH3 + HOSO2OCH3
C2H5OCH3 + HOSO2OCH3
в) межмолекулярная дегидратация в присутствии твердого катализатора
C2H5OH + HOC2H5  C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
2400C
г) алкилирование изоолефинами
CH2 CH3
CH3OH + C-CH3 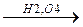 CH3-O-C-CH3
CH3-O-C-CH3
CH3 p,600C CH3
изобутилен
II. Реакции с отрывом группы ОН.
1) Замещение группы ОН на Hal.
а) действие HHal;
б) действие PHаl и PНal5;
в) действие SOCl2 и SO2Cl2 (см. способы получения галогенопроизводных).
2) дегидратация спиртов (внутримолекулярное отщепление воды)
CH3-CH-CH-CH3  H2O + CH3-CH=C-CH3
H2O + CH3-CH=C-CH3
OH CH3 1800C CH3
3-метил-2-бутанол 2-метил-2-бутен
Отщепление водорода идет от наименее гидрированного из 2-х соседних звеньев с гидроксилсодержащими (правило Зайцева).
III. Окисление и дегидрирование спиртов
Отношение спиртов к окислению связано с индукционным влиянием связи С-О. Полярная связь С-О увеличивает подвижность атомов водорода при углероде, связанном с группой ОН.
H
H-C  O
O  H
H
H
1) Окисление первичных спиртов
а) до альдегидов;
H O
CH3-C-H + O  H2O + CH3-C + H2O
H2O + CH3-C + H2O
OH H
б) до кислот
H OH
CH3-C-H + O + O  H2O + CH3-C
H2O + CH3-C
OH O
2) Окисление вторичных спиртов идет до кетонов
H
CH3-C-CH + O  H2O + CH3-C=O
H2O + CH3-C=O
CH3 CH3
3) Третичные спирты при аналогичных условиях не окисляются, т.к. не имеют подвижного атома углерода, связанного с группой ОН. Однако при действии сильных окислителей (концентрированные растворы при высокой температуре), реакция окисления идет с разрушением углеродной цепи. При этом окислению подвергаются соседние звенья (наименее гидрированные), т.к. там больше сказывается индукционное влияние гидроксильной группы.
OH OH OH O HO
CH3-CH2-C-CH3 + O  CH3-CH-C-CH3
CH3-CH-C-CH3  CH3-C-C-CH3
CH3-C-C-CH3 
O O
 CH3-C-OH + C-CH3
CH3-C-OH + C-CH3
CH3
4) Дегидрирование спиртов – под действием катализаторов.
Также происходит с участием самых подвижных атомов водорода: водорода оксигруппы и водорода у соседнего атома углерода.
H H
CH3-C-H  H2 + CH3-C
H2 + CH3-C
OH 100-1800C O
Дегидрирование под действием хлора.
H H
CH3-C-H + Cl2  2HCl + CH-C
2HCl + CH-C
OH O
В реакциях замещения и отщепления водорода наиболее активны спирты первичные, а в реакциях замещения и отщепления группы ОН, наоборот, наиболее легко реагируют спирты третичные.
НЕПРЕДЕЛЬНЫЕ СПИРТЫ
Содержат в составе молекулы группу ОН и двойную или тройную связи. Строение непредельных спиртов имеет ограничение, определяемое правилом Эльтекова. Спирты, у которых группа ОН находится при атоме углерода с двойной связью, в свободном состоянии не существуют
C=C
OH
и уже в процессе образования изомеризуются в соответствующие альдегиды или кетоны, т.к. имеется p-  -сопряжение, повышается подвижность водорода и увеличивается нуклеофильность СН2.
-сопряжение, повышается подвижность водорода и увеличивается нуклеофильность СН2.
 - ..
- ..  +
+
CH2=CH-O-H  CH3-C
CH3-C
Виниловый уксусный
спирт альдегид
Способы получения
Кроме общих способов получения спиртов, применяются:
а) для получения ацетиленовых спиртов – реакция взаимодействия ацетилена с альдегидами и кетонами (см. химические свойства ацетиленовых углеводородов).
O
H-C + CH  CH
CH  CH2-C
CH2-C  CH
CH
H OH
пропаргиловый спирт
б) нагревание глицеринов с щавелевой кислотой
СH2OH HO-C=O CH2-O-C=O CH2
CHOH +  CH2-O-C=O
CH2-O-C=O  CH
CH
CH2OH HO-C=O CH2OH CH2OH
аллиловый спирт
Свойства
Дают реакции спиртов и реакции за счет кратных связей. Легко окисляются, полимеризуются.
Отдельные представители
Виниловый спирт
В свободном состоянии не существует. Однако промышленность выпускает ряд его производных, таких, как
СH2=CH2 винилацетат
OCOCH3
CH2=CH метилвиниловый эфир
OCH3
Используются для получения полимеров, например, ПВС:
nCH2=CH  (-CH2-CH-)n
(-CH2-CH-)n  (-CH2-CH-)n
(-CH2-CH-)n
OCOCH3 OCOCH3 -nCH3COOH OH
поливинилацетат поливиниловый спирт
используется для получения хирургического саморассасывающегося шелка.
Аллиловый спирт
СH2=CH-CH2OH получается из пропилена
СH2=CH-CH3 + Cl2  CH2=CH-CH2Cl + NaOH
CH2=CH-CH2Cl + NaOH  CH2=CH-CH2OH
CH2=CH-CH2OH
+ NaCl хлористый аллил
Используется как мономер при получении смол и пластмасс.
Пропаргиловый спирт
СH  C-CH2OH
C-CH2OH
Применяют для получения глицерина, аллилового спирта, в качестве растворителя высокомолекулярных соединений (полиамидов, ацетатов, целлюлозы), в качестве протравы при гальванических покрытиях металлов.
Многоатомные спирты
|
Просмотров 826 |
|
|
